|
||||
|
6. Переходные металлы 4-го периода. Свойства, способы получения. Общие свойства металлов 6.1. Хром Хром – элемент 4-го периода и VIБ-группы Периодической системы, порядковый номер 24. Электронная формула атома [18Ar]3d54s1, характерные степени окисления +VI, + III и 0. Шкала степеней окисления хрома: 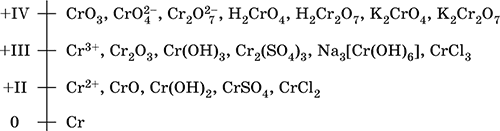 По электроотрицательности (1,56) хром занимает промежуточное положение между типичными металлами (Na, К, Са) и типичными неметаллами (F, О, N. CI, S). Соединения CrIII проявляют амфотерные свойства, металлические (основные) свойства преобладают у CrII, неметаллические (кислотные) – у CrVI; в соединениях хром чаще находится в составе катионов и реже – в составе анионов. Хром образует многочисленные соли и бинарные соединения. В природе – девятнадцатый по химической распространенности элемент (десятый среди металлов), находится только в виде соединений (минералы, полиметаллические руды). Растворимые соли хрома ядовиты. Хром Cr. Серый (с голубоватым оттенком) металл, очень твердый, ковкий (технический продукт – хрупкий). Блестящий, хотя покрыт очень тонкой оксидной пленкой, сохраняет блеск даже во влажном воздухе. Не реагирует с водой, щелочами и гидратом аммиака, пассивируется в концентрированной и разбавленной азотной кислоте и в «царской водке». 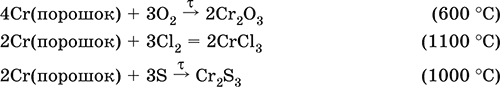 В ряду напряжений стоит левее водорода, из разбавленных кислот HCl и H2SO4 вытесняет водород: Cr + 2H+ = Cr2+ + Н2v Далее катион Cr2+ можно перевести кислотами-окислителями в катион Cr3+:  Хром реагирует в расплаве с сильными окислителями: 2Cr + КClO3 = Cr2O3 + КCl (500–700 °C) 2Cr + 3KNO3 = Cr2O3 + 3KNO2 (400–550 °C) Получение хрома в промышленности – алюминотермия: Cr2O3 + 2Al = 2Cr + Al2O3 (800 °C) и электролиз раствора: 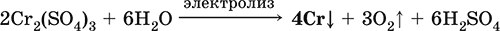 Промышленно важен сплав хрома с железом — феррохром (6O—85 % хрома), его производят восстановлением оксидов, например минерала хромит: 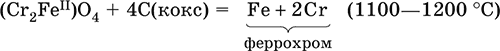 Применяется хром для создания защитных покрытий на других металлах (хромирование), как компонент механически прочных и коррозионно-стойких сталей. Гидроксид хрома (III) Cr(ОН)3. Амфотерный гидроксид. Серо-зеленый, разлагается при нагревании, теряя воду и образуя зеленый метагидроксид CrО(ОН). Не растворяется в воде. Из раствора осаждается в виде серо-голубого и голубовато-зеленого гидрата. Реагирует с кислотами и щелочами, не взаимодействует с гидратом аммиака. Применяется для синтеза соединений хрома (III). Уравнения важнейших реакций: 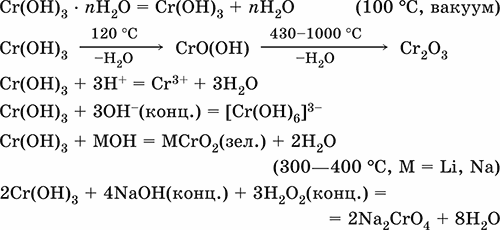 Получение: осаждение гидратом аммиака из растора солей хрома(III): Cr3+ + 3(NH3 Н2O) = Cr(OH)3v + 3NH4+ Хромат калия К2CrO4. Оксосоль. Желтый, негигроскопичный. Плавится без разложения, термически устойчивый. Хорошо растворим в воде (желтая окраска раствора отвечает иону CrO42-), незначительно гидролизуется по аниону. В кислотной среде переходит в К2Cr2O7. Окислитель (более слабый, чем К2Cr2O7). Вступает в реакции ионного обмена. Качественная реакция на ион CrO42- – выпадение желтого осадка хромата бария, разлагающегося в сильнокислотной среде. Применяется как протрава при крашении тканей, дубитель кож, селективный окислитель, реактив в аналитической химии. Уравнения важнейших реакций: 2К2CrO4 + H2SO4 (30 %) = К2Cr2O7 + K2SO4 + Н2O 2К2CrO4(т) + 16HCl (конц., гор.) = 2CrCl3 + ЗCl3^ + 8H2O + 4КCl 2К2CrO4 + 2H2O + 3H2S = 2Cr(OH)3v + 3Sv + 4KOH 2К2CrO4 + 8H2O + 3K2S = 2K3[Cr(OH)6] + 3Sv + 4KOH 2К2CrO4 + 2AgNO3 = 2KNO3 + Ag2CrO4 (красн.)v Качественная реакция: К2CrO4 + ВаCl2 = 2КCl + ВаCrO4v 2BaCrO4(т) + 2HCl (разб.) = ВаCr2O7(р) + ВаCl2 + Н2O Получение: спекание хромита с поташом на воздухе: 4(Cr2FeII)O4 + 8К2СO3 + 7O2 = 8К2CrO4 + 2Fe2O3 + 8СO2 (1000 °C) Дихромат калия К2Cr2O7. Оксосоль. Техническое название хромпик. Оранжево-красный, негигроскопичный. Плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворим в воде (оранжевая окраска раствора отвечает иону Cr2O72-). В щелочной среде образует К2CrO4. Типичный окислитель в растворе и при сплавлении. Вступает в реакции ионного обмена. Качественные реакции – синее окрашивание эфирного раствора в присутствии Н2O2, синее окрашивание водного раствора при действии атомарного водорода. Применяется как дубитель кож, протрава при крашении тканей, компонент пиротехнических составов, реагент в аналитической химии, ингибитор коррозии металлов, в смеси с H2SO4 (конц.) – для мытья химической посуды. Уравнения важнейших реакций:  6.2. Марганец Марганец – элемент 4-го периода и VIIB-группы Периодической системы, порядковый номер 25. Электронная формула атома [18Ar]3d54s2; характерные степени окисления +VII, +VI, +IV, +II и 0. Шкала степеней окисления марганца: 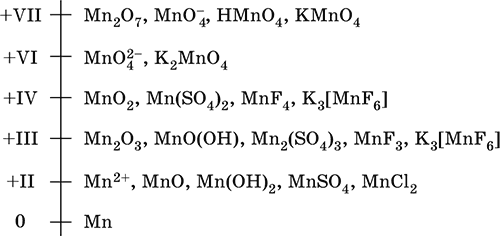 По электроотрицательности (1,60) марганец занимает промежуточное положение между типичными металлами (Na, К, Са, Mg) и неметаллами (F, О, N, Cl). Соединения MnII – оксид и гидроксид – проявляют основные свойства, соединения MnIII и MnIV – амфотерные свойства, для соединений MnVI и MnVII характерно почти полное преобладание кислотных свойств. Марганец образует многочисленные соли и бинарные соединения. В природе – четырнадцатый по химической распространенности элемент (восьмой среди металлов; второй, после железа, тяжелый металл). Марганец Mn. Серебристо-белый (с серым оттенком) металл, более твердый и хрупкий по сравнению с железом. В виде мелкого порошка пирофорен. На воздухе покрывается оксидной пленкой. Пассивируется в воде, поглощает водород, но не реагирует с ним. При нагревании сгорает в кислороде воздуха, реагирует с хлором и серой: 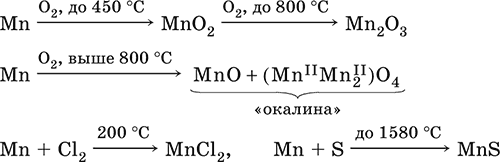 В ряду напряжений марганец стоит левее водорода, из разбавленных кислот HCl и H2SO4 вытесняет водород: Mn (порошок) + 2H+ = Mn2+ + Н2^ Взаимодействует с кислотами-окислителями при нагревании, также образуя соли марганца (II): Mn + 2H2SO4 (конц.) = MnSO4 + SO2^ + 2Н2O ЗMn + 8HNO3 (разб.) = 3Mn(NO3)2 + 2NO^ + 4Н2O Получение марганца в промышленности – восстановление пиролюзита MnO2 или гаусманита (MnIIMn2III)O4 коксом или алюминием: MnO2 + С (кокс) = Mn + СO2 (600 °C) 3(MnIIMn2III)O4 + 8Al = 9Mn + 4Al2O3 (700–900 °C) Наиболее чистый марганец выделяют электролизом раствора из солей марганца(II), например: 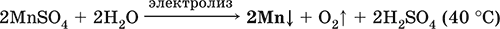 Промышленно важен сплав с железом — ферромарганец (> 70 % Mn), его получают восстановлением оксидных руд марганца и железа. Применяется марганец для изготовления специальных и тугоплавких сплавов, зеркального чугуна и марганцевых твердых сталей, в качестве катализатора в органическом синтезе. Оксид марганца (IV) MnO2. Черный, с коричневым оттенком, при нагревании разлагается. Из раствора осаждается в виде черного гидрата MnO2 nН2O. Не проявляет амфотерных свойств в силу малой реакционной способности по отношению к воде, разбавленным кислотам НCl и H2SO4, азотной кислоте и щелочам в растворе. Типичный окислитель в растворе и расплаве, менее характерны свойства восстановителя. Применяется для промышленного производства марганца, как деполяризатор в «батарейках» (сухих гальванических элементах), компонент минеральных пигментов, осветлитель стекла. Уравнения важнейших реакций: 4MnO2 = 2Mn2O3 + O2 (530–585 °C) 2MnO2 + 2H2SO4 (конц.) = MnSO4 + O2^ + 2Н2O (кипячение) MnO2 + 4HCl (конц.) = MnCl2 + Cl2^ + 2H2O MnO2 + H2SO4 (гор.) + KNO2 = MnSO4 + KNO3 + H2O MnO2 + 2H2SO4 + 2FeSO4 = MnSO4 + Fe2(SO4)3 + 2H2O MnO2 + 2KOH + KNO3 = K2MnO4 + KNO2 + H2O (350–450 °C) 3MnO2 + 3K2CO3 + KClO3 = 3K2MnO4 + KCl + 3CO2 (400 °C) В природе самое распространенное соединение марганца – минерал пиролюзит. Манганат калия К2MnO4. Оксосоль. Темно-зеленый, плавится под избыточным давлением O2. В растворе устойчив только в сильнощелочной среде. Зеленая окраска раствора отвечает иону MnO42-. Медленно разлагается при разбавлении раствора водой, быстро – при подкислении. Проявляет окислительно-восстановительные свойства. Качественная реакция – появление фиолетовой окраски при подкислении раствора. Промежуточный продукт при синтезе КMnO4. Уравнения важнейших реакций: 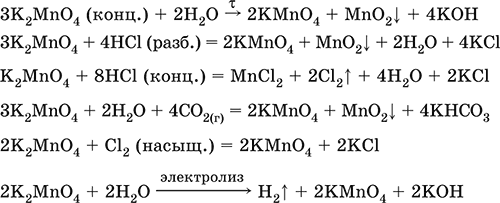 Получение: сплавление MnO2 с сильными окислителями (KNO3, КСlO3). Пермапгапат калия КMnO4. Оксосоль. Красно-фиолетовый (почти черный). При нагревании разлагается без плавления. Умеренно растворим в воде (интенсивно-фиолетовая окраска раствора отвечает иону MnO4-), гидролиза нет. Медленно разлагается в воде, серной кислоте, щелочах. Сильный окислитель в растворе и при сплавлении; в сильнокислотной среде восстанавливается до MnII, в нейтральной среде – до MnIV, в сильнощелочной среде – до MnVI. Качественная реакция на ион MnO4- – исчезновение фиолетовой окраски раствора при восстановлении в кислотной среде. Применяется как окислитель углеводородов до карбоновых кислот, реактив в фотографии, антисептик в медицине, средство для очистки газов и отбеливания тканей, твердый источник кислорода. Распространенный окислитель в лабораторной практике. Уравнения важнейших реакций: 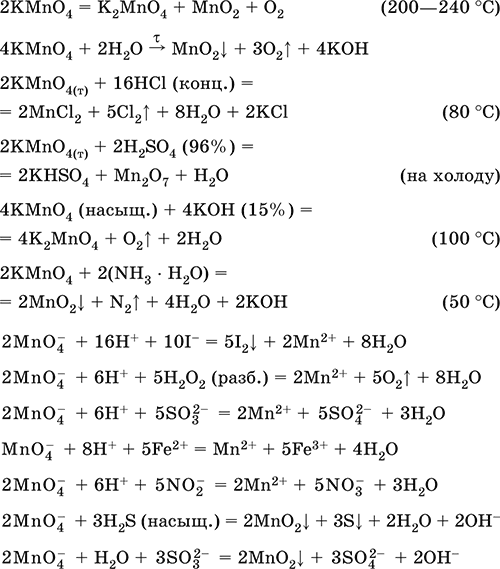 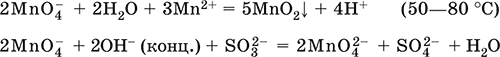 Получение – электролиз раствора K2MnO4 (см.). 6.3. Железо Железо – элемент 4-го периода и VIIIБ-группы Периодической системы, порядковый номер 26. Вместе с кобальтом Со и никелем Ni образует семейство (триаду) железа. Электронная формула атома [18Ar]3d64s2, характерные степени окисления 0, +II и +III (последняя наиболее устойчива). Шкала степеней окисления железа: 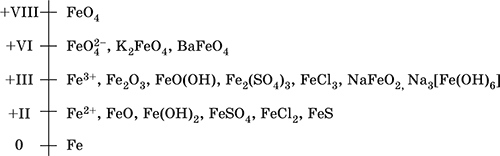 По электроотрицательности (1,64) железо занимает промежуточное положение между типичными металлами (Na, Са) и типичными неметаллами (F, О, N). Проявляет амфотерные свойства, металлические (основные) свойства преобладают над неметаллическими (кислотными), в соединениях находится в составе катионов (чаще) и анионов (реже). Образует многочисленные соли и бинарные соединения. В природе – седьмой по химической распространенности элемент (четвертый среди металлов, первый тяжелый металл); находится в химически связанном виде. Жизненно важный элемент для всех организмов. Железо Fe. Простое вещество. Серый мягкий, ковкий, тугоплавкий металл. Обычное железо медленно окисляется во влажном воздухе (ржавеет), чистое железо коррозии не подвергается. Не реагирует с водой, пассивируется в концентрированных серной и азотной кислотах. Компактный металл покрывается при нагревании на воздухе оксидной пленкой (окалиной), а порошок сгорает; реагирует с хлором и серой: 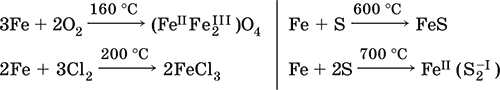 Восстанавливает водяной пар (старый способ получения водорода в промышленности): 3Fe + 4Н2O (пар) = (FeIIFe2III)O4+ 4Н2 (800 °C) В ряду напряжений стоит левее водорода, реагирует с разбавленными кислотами НCl и H2SO4, при этом образуются соли железа(II) и выделяется водород: Fe + 2Н+ = Fe2+ + Н2^ (реакции проводятся без доступа воздуха, иначе FeII постепенно переводится кислородом в FeIII). При действии на железо более сильного окислителя (здесь – азотная кислота) оно сразу переходит в катион Fe3+: Fe + 4HNO3 (разб.) = Fe(NO3)3 + NO^ + 2H2O Амфотерность железа проявляется только в концентрированных щелочах при кипячении: Fe + 2NaOH (50 %) + 2Н2O = Na2[Fe(OH)4]v + Н2^ и образуется осадок тетрагидроксоферрата(II) натрия. Железо вытесняет (по ряду напряжений) менее активные металлы из растворов их солей: Fe + CuSO4 = FeSO4 + Cuv Железо медленно окисляется во влажном воздухе (ржавеет), из-за рыхлости коричневой ржавчины (FeIIFe2III)O4 защитный слой не создается. Процесс ржавления: 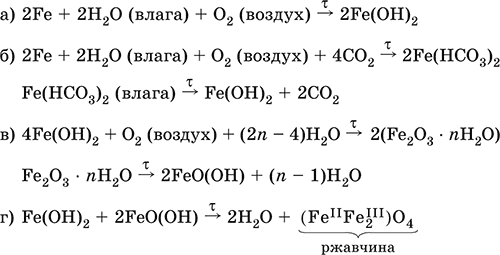 Техническое железо – сплавы железа с углеродом: чугун содержит 2,06—6,67 % С, сталь 0,02—2,06 % С, часто присутствуют другие естественные примеси (S, Р, Si) и вводимые искусственно специальные добавки (Mn, Ni, Cr), что придает сплавам железа технически полезные свойства – твердость, термическую и коррозионную стойкость, ковкость и др. Доменный процесс производства чугунаДоменный процесс производства чугуна составляют следующие стадии: а) подготовка (обжиг) сульфидных и карбонатных руд – перевод в оксидную руду: 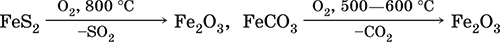 б) сжигание кокса при горячем дутье: 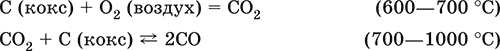 в) восстановление оксидной руды угарным газом СО последовательно (см. рубрики соответствующих оксидов): 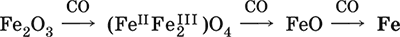 г) науглероживание железа (до 6,67 % С) и расплавление чугуна: 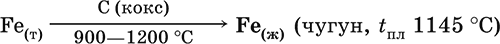 В чугуне всегда в виде зерен присутствуют цементит Fe2C и графит. Производство сталиПередел чугуна в сталь проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева; температура процесса 1700–2000 °C. Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов. При этом оксиды либо улавливаются в виде отходящих газов (СO2, SO2), либо связываются в легко отделяемый шлак – смесь Са3(РO4)2 и CaSiO3. Для получения специальных сталей в печь вводят легирующие добавки других металлов. Получение чистого железа в промышленности – электролиз раствора солей железа, например: 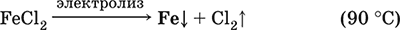 (существуют и другие специальные методы, в том числе восстановление оксидов железа водородом). Чистое железо применяется в производстве специальных сплавов, при изготовлении сердечников электромагнитов и трансформаторов, чугун – в производстве литья и стали, сталь – как конструкционный и инструментальный материалы, в том числе износо-, жаро– и коррозионно-стойкие. Оксид железа(II) FeO. Амфотерный оксид с большим преобладанием основных свойств. Черный, имеет ионное строение Fe2+O2-. При нагревании вначале разлагается, затем образуется вновь. Не образуется при сгорании железа на воздухе. Не реагирует с водой. Разлагается кислотами, сплавляется со щелочами. Медленно окисляется во влажном воздухе. Восстанавливается водородом, коксом. Участвует в доменном процессе выплавки чугуна. Применяется как компонент керамики и минеральных красок. Уравнения важнейших реакций: 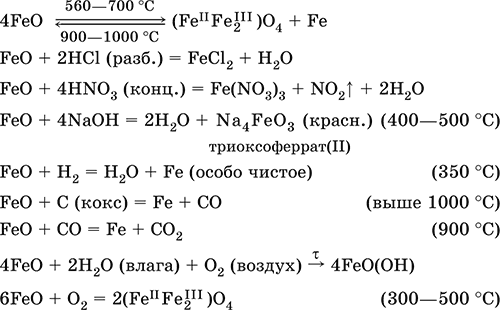 Получение в лаборатории: термическое разложение соединений железа (II) без доступа воздуха: Fe(OH)2 = FeO + H2O (150–200 °C) FeCO3 = FeO + СO2 (490–550 °C) Оксид дижелеза (III) – железа(II) (FeIIFe2III)O4. Двойной оксид. Черный, имеет ионное строение Fe2+(Fe3+)2(O2-)4. Термически устойчив до высоких температур. Не реагирует с водой. Разлагается кислотами. Восстанавливается водородом, раскаленным железом. Участвует в доменном процессе производства чугуна. Применяется как компонент минеральных красок (железный сурик), керамики, цветного цемента. Продукт специального окисления поверхности стальных изделий (чернение, воронение). По составу отвечает коричневой ржавчине и темной окалине на железе. Применение брутто-формулы Fe3O4 не рекомендуется. Уравнения важнейших реакций: 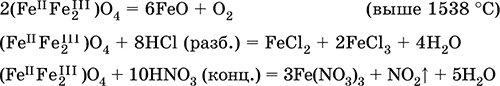 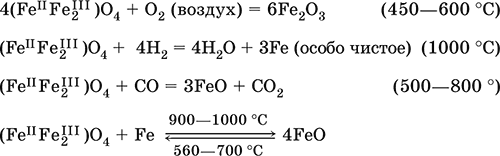 Получение: сгорание железа (см.) на воздухе. В природе – оксидная руда железа магнетит. Оксид железа(III) Fe2O3. Амфотерный оксид с преобладанием основных свойств. Красно-коричневый, имеет ионное строение (Fe3+)2(O2-)3. Термически устойчив до высоких температур. Не образуется при сгорании железа на воздухе. Не реагирует с водой, из раствора выпадает бурый аморфный гидрат Fe2O3 nН2O. Медленно реагирует с кислотами и щелочами. Восстанавливается монооксидом углерода, расплавленным железом. Сплавляется с оксидами других металлов и образует двойные оксиды — шпинели (технические продукты называются ферритами). Применяется как сырье при выплавке чугуна в доменном процессе, катализатор в производстве аммиака, компонент керамики, цветных цементов и минеральных красок, при термитной сварке стальных конструкций, как носитель звука и изображения на магнитных лентах, как полирующее средство для стали и стекла. Уравнения важнейших реакций: 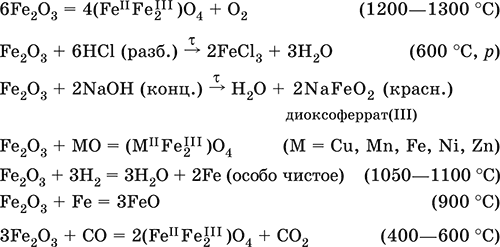 Получение в лаборатории – термическое разложение солей железа(III) на воздухе: Fe2(SO4)3 = Fe2O3 + 3SO3 (500–700 °C) 4{Fe(NO3)3 9 H2O} = 2FeaO3 + 12NO2 + 3O2 + 36H2O (600–700 °C) В природе – оксидные руды железа гематит Fe2O3 и лимонит Fe2O3 nН2O. Гидроксид железа (II) Fe(OH)2. Амфотерный гидроксид с преобладанием основных свойств. Белый (иногда с зеленоватым оттенком), связи Fe – ОН преимущественно ковалентные. Термически неустойчив. Легко окисляется на воздухе, особенно во влажном состоянии (темнеет). Нерастворим в воде. Реагирует с разбавленными кислотами, концентрированными щелочами. Типичный восстановитель. Промежуточный продукт при ржавлении железа. Применяется в изготовлении активной массы железоникелевых аккумуляторов. Уравнения важнейших реакций: 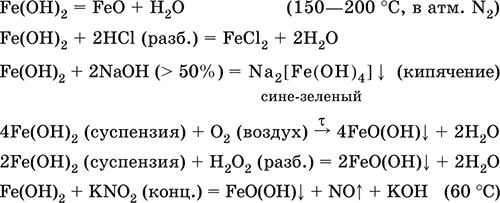 Получение: осаждение из раствора щелочами или гидратом аммиака в инертной атмосфере: Fe2+ + 2OН(разб.) = Fe(OH)2v Fe2+ + 2(NH3 H2O) = Fe(OH)2v + 2NH4+ Метагидроксид железа FeO(OH). Амфотерный гидроксид с преобладанием основных свойств. Светло-коричневый, связи Fe – О и Fe – ОН преимущественно ковалентные. При нагревании разлагается без плавления. Нерастворим в воде. Осаждается из раствора в виде бурого аморфного полигидрата Fe2O3 nН2O, который при выдерживании под разбавленным щелочным раствором или при высушивании переходит в FeO(OH). Реагирует с кислотами, твердыми щелочами. Слабый окислитель и восстановитель. Спекается с Fe(OH)2. Промежуточный продукт при ржавлении железа. Применяется как основа желтых минеральных красок и эмалей, поглотитель отходящих газов, катализатор в органическом синтезе. Соединение состава Fe(OH)3 не известно (не получено). Уравнения важнейших реакций: 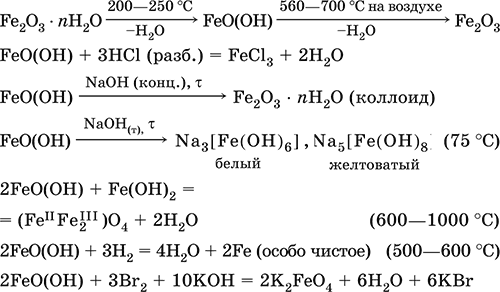 Получение: осаждение из раствора солей железа(III) гидрата Fe2O3 nН2O и его частичное обезвоживание (см. выше). В природе – оксидная руда железа лимонит Fe2O3 nН2O и минерал гётит FeO(OH). Феррат калия K2FeO4. Оксосоль. Красно-фиолетовый, разлагается при сильном нагревании. Хорошо растворим в концентрированном растворе КОН, реагирует с кипящей водой, неустойчив в кислотной среде. Сильный окислитель. Качественная реакция – образование красного осадка феррата бария. Применяется в синтезе ферритов – промышленно важных двойных оксидов железа (III) и других металлов. Уравнения важнейших реакций: 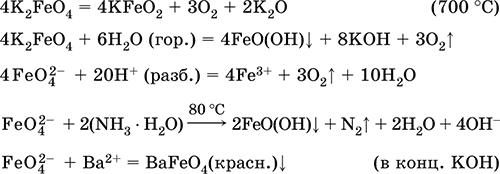 Получение: образуется при окислении соединений железа, например метагидроксида FeO(OH), бромной водой, а также при действии сильных окислителей (при спекании) на железо Fe + 2KOH + 2KNO3 = K2FeO4 + 3KNO2 + H2O (420 °C) и электролизе в растворе: 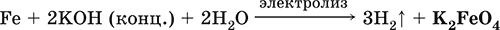 (феррат калия образуется на аноде). Качественные реакции на ионы Fe2+ и Fe3+. Обнаружение ионов Fe2+ и Fe3+ в водном растворе проводят с помощью реактивов K3[Fe(CN)6] и K4[Fe(CN)6] соответственно; в обоих случаях выпадает синий продукт одинакового состава и строения, KFeIII[FeII(CN)6]. В лаборатории этот осадок называют берлинская лазурь, или турнбуллева синь: Fe2+ + К+ + [Fe(CN)6]3- = KFeIII[FeII(CN)6]v Fe3+ + K+ + [Fe(CN)6]4- = KFeIII[FeII(CN)6]v Химические названия исходных реактивов и продукта реакций: K3[Fe(CN)6] – гексацианоферрат (III) калия K4[Fe(CN)6] – гексацианоферрат (II) калия KFeIII[FeII(CN)6] – гексацианоферрат (II) железа(III) калия Кроме того, хорошим реактивом на ионы Fe3+ является тиоцианат-ион NCS-, железо (III) соединяется с ним, и появляется ярко-красная («кровавая») окраска: Fe3+ + 6NCS– = [Fe(NCS)6]3- Этим реактивом (например, в виде соли KNCS) можно обнаружить даже следы железа (III) в водопроводной воде, если она проходит через железные трубы, покрытые изнутри ржавчиной. 6.4. Общие свойства металлов. Коррозия Элементы с металлическими свойствами расположены в IA – VIA группах Периодической системы (табл. 7). 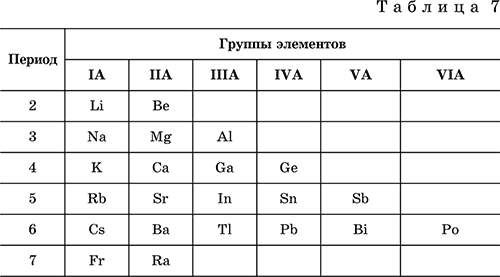 Металлами являются также все элементы, расположенные в IБ – VIIIБ-группах (переходные металлы). В настоящее время в Периодической системе 92 металла. Типичными металлами являются s-элементы (элементы IA-группы от Li до Fr, элементы IIA-группы от Mg до Ra). Общая электронная формула их атомов ns1–2. Для них характерны степени окисления +I и +II соответственно. Небольшое число электронов (1–2) на внешнем энергетическом уровне атомов типичных металлов предполагает легкую потерю этих электронов и проявление сильных восстановительных свойств, что отражают низкие значения электроотрицательности. Отсюда вытекает ограниченность химических свойств и способов получения типичных металлов. Характерной особенностью типичных металлов является стремление их атомов образовывать катионы и ионные химические связи с атомами неметаллов. Соединения типичных металлов с неметаллами – это ионные кристаллы «катион металлаанион неметалла», например К+Br-, Са2+O2-. Катионы типичных металлов входят также в состав соединений со сложными анионами – гидроксидов и солей, например Mg2+(OH-)2, (Li+)2CO32-. Металлы А-групп, образующие диагональ амфотерности в Периодической системе Be-Al-Ge-Sb-Po, а также примыкающие к ним металлы (Ga, In, Tl, Sn, Pb, Bi) не проявляют типично металлических свойств. Общая электронная формула их атомов ns2np0–4 предполагает большее разнообразие степеней окисления, большую способность удерживать собственные электроны, постепенное понижение их восстановительной способности и появление окислительной способности, особенно в высоких степенях окисления (характерные примеры – соединения ТlIII, PbIV, Biv). Подобное химическое поведение характерно и для большинства d-элементов, т. е. элементов Б-групп Периодической системы (типичные примеры – амфотерные элементы Cr и Zn). Это проявление двойственности (амфотерности) свойств, одновременно металлических (основных) и неметаллических, обусловлено характером химической связи. В твердом состоянии соединения нетипичных металлов с неметаллами содержат преимущественно ковалентные связи (но менее прочные, чем связи между неметаллами). В растворе эти связи легко разрываются, а соединения диссоциируют на ионы (полностью или частично). Например, металл галлий состоит из молекул Ga2, в твердом состоянии хлориды алюминия и ртути(II) AlCl3 и HgCl2 содержат сильно ковалентные связи, но в растворе AlCl3 диссоциирует почти полностью, a HgCl2 – в очень малой степени (да и то на ионы HgCl+ и Cl-). В свободном виде все металлы – твердые вещества, кроме одного – ртути Hg, которая при обычных условиях жидкость. В кристаллах металлов преобладает особый вид связи (металлическая связь); валентные электроны слабо связаны с конкретным атомом в решетке, и внутри металла существует так называемый электронный газ. Все металлы обладают высокой электропроводимостью (наибольшая y Ag, Cu, Аи, Al, Mg) и теплопроводностью. Встречаются низкоплавкие металлы (цезий Cs с температурой плавления 28,7 °C плавится от тепла руки) и, наоборот, весьма тугоплавкие (вольфрам W плавится лишь при 3387 °C). Отличительным свойством металлов служит их пластичность (ковкость), вследствие чего они могут быть прокатаны в тонкие листы – фольгу (Sn, Al, Au) или вытянуты в проволоку (Cu, Al, Fe), однако встречаются и очень хрупкие металлы (Zn, Sb, Bi). В промышленности часто используют не чистые металлы, а их смеси — сплавы, в которых полезные свойства одного металла дополняются полезными свойствами другого. Так, медь обладает невысокой твердостью и малопригодна для изготовления деталей машин, сплавы же меди с цинком (латунь) являются уже достаточно твердыми и широко используются в машиностроении. Алюминий обладает высокой пластичностью и достаточной легкостью (малой плотностью), но слишком мягок. На его основе готовят сплав с магнием, медью и марганцем – дуралюмин (дюраль), который, не теряя полезных свойств алюминия, приобретает высокую твердость и становится пригодным в авиастроении. Сплавы железа с углеродом (и добавками других металлов) – это широко известные чугун и сталь. Металлы в свободном виде являются восстановителями. Однако реакционная способность некоторых металлов невелика из-за того, что они покрыты поверхностной оксидной пленкой, в разной степени устойчивой к действию таких химических реактивов, как вода, растворы кислот и щелочей. Например, свинец всегда покрыт оксидной пленкой, для его перехода в раствор требуется не только воздействие реактива (например, разбавленной азотной кислоты), но и нагревание. Оксидная пленка на алюминии препятствует его реакции с водой, но под действием кислот и щелочей разрушается. Рыхлая оксидная пленка {ржавчина), образующаяся на поверхности железа во влажном воздухе, не мешает дальнейшему окислению железа. Под действием концентрированных кислот на металлах образуется устойчивая оксидная пленка. Это явление называется пассивацией. Так, в концентрированной серной кислоте пассивируются (и после этого не реагируют с кислотой) такие металлы, как Be, Bi, Со, Fe, Mg и Nb, а в концентрированной азотной кислоте – металлы Al, Be, Bi, Со, Cr, Fe, Nb, Ni, Pb, Th и U. При взаимодействии с окислителями в кислых растворах большинство металлов переходит в катионы, заряд которых определяется устойчивой степенью окисления данного элемента в соединениях (Na+, Са2+, Al3+, Fe2+ и Fe3+). Восстановительная активность металлов в кислом растворе передается рядом напряжений. Большинство металлов переводится в раствор соляной и разбавленной серной кислотами, но Cu, Ag и Hg – только серной (концентрированной) и азотной кислотами, a Pt и Аи – «царской водкой». Нежелательным химическим свойством металлов является их коррозия, т. е. активное разрушение (окисление) при контакте с водой и под воздействием растворенного в ней кислорода (кислородная коррозия). Например, широко известна коррозия железных изделий в воде, в результате чего образуется ржавчина, и изделия рассыпаются в порошок. Коррозия металлов протекает в воде также из-за присутствия растворенных газов СO2 и SO2; создается кислотная среда, и катионы Н+ вытесняются активными металлами в виде водорода Н2 (водородная коррозия). Особенно коррозионно-опасным может быть место контакта двух разнородных металлов (контактная коррозия). Между одним металлом, например Fe, и другим металлом, например Sn или Cu, помещенными в воду, возникает гальваническая пара. Поток электронов идет от более активного металла, стоящего левее в ряду напряжений (Fe), к менее активному металлу (Sn, Cu), и более активный металл разрушается (корродирует). Именно из-за этого ржавеет луженая поверхность консервных банок (железо, покрытое оловом) при хранении во влажной атмосфере и небрежном обращении с ними (железо быстро разрушается после появления хотя бы небольшой царапины, допускающей контакт железа с влагой). Напротив, оцинкованная поверхность железного ведра долго не ржавеет, поскольку даже при наличии царапин корродирует не железо, а цинк (более активный металл, чем железо). Сопротивление коррозии для данного металла усиливается при его покрытии более активным металлом или при их сплавлении; так, покрытие железа хромом или изготовление сплава железа с хромом устраняет коррозию железа. Хромированное железо и сталь, содержащая хром (нержавеющая сталь), имеют высокую коррозионную стойкость. Общие способы получения металлов в промышленности: • электрометаллургия, т. е. получение металлов электролизом расплавов (для наиболее активных металлов) или растворов солей; • пирометаллургия, т. е. восстановление металлов из руд при высокой температуре (например, получение железа в доменном процессе); • гидрометаллургия, т. е. выделение металлов из растворов их солей более активными металлами (например, получение меди из раствора CuSO4 действием цинка, железа или алюминия). В природе иногда встречаются самородные металлы (характерные примеры – Ag, Au, Pt, Hg), но чаще металлы находятся в виде соединений (металлические руды). По распространенности в земной коре металлы различны: от наиболее распространенных – Al, Na, Са, Fe, Mg, К, Ti до самых редких – Bi, In, Ag, Au, Pt, Re. Примеры заданий части A1. В железосодержащих продуктах реакций между железом и разбавленными кислотами HCl, H2SO4 и HNO3 общая сумма числа атомов всех элементов равна 1) 14 2) 18 3) 22 4) 26 2. В уравнениях реакций Fe + O2 > (FeIIFeIII2)O4 Fe + Cl2 > FeCl3 Fe + Н2O (пар) > (FeIIFeIII2)O4 + Н2 общая сумма коэффициентов равна 1) 6 2) 7 3) 12 4) 25 3. Соль NaCrO2 получают при взаимодействии между 1) CrO3 и Na2O 2) Cr2O3 и Na2CO3 3) CrО и NaOH 4) CrO2 и NaHCO3 4. Будет протекать реакция при внесении меди в разбавленные растворы 1) бромоводорода 2) нитрата ртути(II) 3) серной кислоты 4) азотной кислоты 5. Протекают реакции 1) H2SO4 + FeCO3 >… 2) AgNO3 + HI (p-p) >… 3) K2Cr2O7 (p-p) + PbO2 >… 4) AgNOg (p-p) + Au >… 6—9. Масса тигля из 6. платины 7. меди 8. серебра 9. железа при прокаливании на воздухе 1) уменьшается 2) увеличивается 3) не изменяется 4) не знаю 10—11. В молекулярных уравнениях реакций 10. Fe2O3 + HNOg >…, Fe(OH)2 + O2 > FeO(OH) +… 11. CuO + С > CO2 + Cu, Fe2O3 + CO > Fe +… общая сумма коэффициентов равна 1) 12 2) 15 3) 16 4) 22 12. Сплав, оба компонента которого реагируют с концентрированной азотной кислотой, – это 1) Al + Cu 2) Pt + Аu 3) Hg + Ag 4) Fe + Cr 13. He протекает реакция замещения между реагентами 1) CuSO4 и Zn 2) Pb(NO3)2 и Cr 3) Fe и ZnSO4 4) Cd и Hg(NO3)2 14. Для удаления примеси NiSO4 из раствора FeSO4 надо добавить 1) хлорид бария 2) нитрат серебра(I) 3) гидроксид калия 4) железо 15. Пластинка металла окажется покрытой другим металлом, взятым в виде раствора соли, в наборах 1) Zn и Pb(NO3)2 2) Cu и Hg(NO3)2 3) Со и MnSO4 4) Pb и CrCl3 16—17. Коррозия стального изделия, склепанного с 16. хромом 17. никелем во влажном воздухе 1) усиливается 2) ослабевает 3) не изменяется 4) не знаю |
|
|||
|
Главная | Контакты | Прислать материал | Добавить в избранное | Сообщить об ошибке |
||||
|
|
||||
