|
||||
|
5. Металлы главных подгрупп I–III групп 5.1. Натрий Натрий – элемент 3-го периода и IA-группы Периодической системы, порядковый номер 11. Электронная формула атома [10Ne]3s1, степени окисления +I и 0. Имеет малую электроотрицательность (0,93), проявляет только металлические (основные) свойства. Образует (как катион) многочисленные соли и бинарные соединения. Почти все соли натрия хорошо растворимы в воде. В природе – пятый по химической распространенности элемент (второй среди металлов), встречается только в виде соединений. Жизненно важный элемент для всех организмов. Натрий, катион натрия и его соединения окрашивают пламя газовой горелки в ярко-желтый цвет (качественное обнаружение). Натрий Na. Серебристо-белый металл, легкий, мягкий (режется ножом), низкоплавкий. Хранят натрий в керосине. С ртутью образует жидкий сплав — амальгаму (до 0,2 % Na). Весьма реакционноспособный, во влажном воздухе натрий медленно покрывается гидроксидной пленкой и теряет блеск (тускнеет): 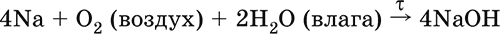 Натрий химически активен, сильный восстановитель. Воспламеняется на воздухе при умеренном нагревании (>250 °C), реагирует с неметаллами: 2Na + O2 = Na2O2 2Na + H2 = 2NaH 2Na + Cl2 = 2NaCl 2Na + S = Na2S 6Na + N2 = 2Na3N 2Na + 2C = Na2C2 Очень бурно и с большим экзо-эффектом натрий реагирует с водой: 2Na + 2H2O = 2NaOH + Н2^ + 368 кДж От теплоты реакции кусочки натрия расплавляются в шарики, которые начинают беспорядочно двигаться из-за выделения Н2. Реакция сопровождается резкими щелчками вследствие взрывов гремучего газа (Н2 + O2). Раствор окрашивается фенолфталеином в малиновый цвет (щелочная среда). В ряду напряжений натрий стоит значительно левее водорода, из разбавленных кислот HCl и H2SO4 вытесняет водород (за счет Н2O и Н+). Получение натрия в промышленности: 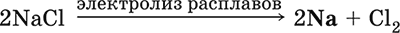 (см. также ниже получение NaOH). Натрий применяется для получения Na2O2, NaOH, NaH, а также в органическом синтезе. Расплавленный натрий служит теплоносителем в ядерных реакторах, а газообразный – используется как наполнитель желтосветных ламп наружного освещения. Оксид натрия Na2O. Основный оксид. Белый, имеет ионное строение (Na+)2O2-. Термически устойчивый, при прокаливании медленно разлагается, плавится под избыточным давлением пара Na. Чувствителен к влаге и углекислому газу в воздухе. Энергично реагирует с водой (образуется сильнощелочной раствор), кислотами, кислотными и амфотерными оксидами, кислородом (под давлением). Применяется для синтеза солей натрия. Не образуется при сжигании натрия на воздухе. Уравнения важнейших реакций: 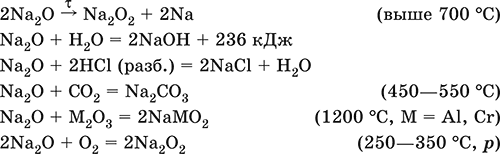 Получение: термическое разложение Na2O2 (см.), а также сплавление Na и NaOH, Na и Na2O2: 2Na + 2NaOH = 2NaaO + H2 (600 °C) 2Na + Na2O2 = 2NaaO (130–200 °C) Пероксид натрия Na2O2. Бинарное соединение. Белый, гигроскопичный. Имеет ионное строение (Na+)2O22-. При нагревании разлагается, плавится под избыточным давлением O2. Поглощает углекислый газ из воздуха. Полностью разлагается водой, кислотами (выделение O2 при кипячении — качественная реакция на пероксиды). Сильный окислитель, слабый восстановитель. Применяется для регенерации кислорода в изолирующих дыхательных приборах (реакция с СO2), как компонент отбеливателей ткани и бумаги. Уравнения важнейших реакций: 2Na2O2 = 2Na2O + O2 (400–675 °C, вакуум) Na2O2 + 2Н2O = Н2O2 + 2NaOH (на холоду) 2Na2O2 + 2Н2O = O2^ + 4NaOH (кипячение) Na2O2 + 2НCl (разб.) = 2NaCl + Н2O2 (на холоду) 2Na2O2 + 4НCl (разб.) = 4НCl + 2Н2O + O2^ (кипячение) 2Na2O2 + 2CO2 = Na2CO3 + O2 Na2O2 + CO = Na2CO3 Na2O2 + 4H+ + 2I- = I2v + 2H2O + 2Na+ 5Na2O2 + 16H+ + 2MnO4- = 5O2^ + 2Mn2+ + 8H2O + 10Na+ 3Na2O2 + 2[Cr(OH)6]3- = 2CrO24- + 8OH- + 2H2O + 6Na+ (80 °C) Получение: сжигание Na на воздухе. Гидроксид натрия NaOH. Основный гидроксид, щелочь, техническое название едкий натр. Белые кристаллы с ионным строением (Na+)(OH-). Расплывается на воздухе, поглощая влагу и углекислый газ (образуется NaHCO3). Плавится и кипит без разложения. Вызывает тяжелые ожоги кожи и глаз. Хорошо растворим в воде (с экзо-эффектом, +56 кДж). Реагирует с кислотными оксидами, нейтрализует кислоты, вызывает кислотную функцию у амфотерных оксидов и гидроксидов: 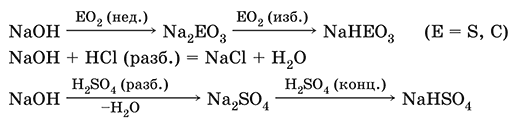 NaOH (разб.) + H3PO4 (конц.) = NaH2PO4 + H2O 2NaOH (разб.) + H3PO4 (разб.) = Na2HPO4 + 2H2O 3NaOH (конц.) + H3PO4 (разб.) = Na3PO4 + 3H2O 2NaOH(T) + M2O3 = 2NaMO2 + H2O (1000 °C, M = Al, Cr) 2NaOH (конц.) + 3H2O + AI2O3 = 2Na[Al(OH)4] (кипячение) 2NaOH(T) + M(OH)2 = Na2MO2 + 2H2O (500 °C, M = Be, Zn) 2NaOH (конц.) + Zn(OH)2 = Na2[Zn(OH)4] Осаждает нерастворимые гидроксиды: 2NaOH + MCl2 = 2NaCl + M(OH)2v (M = Mg, Cu) Подвергает дисмутации галогены и серу: 2NaOH (конц., хол.) + Е2 = NaE + NaEO + H2O (Е = Cl, Br) 6NaOH (разб., гор.) + 3S = 2Na2S + Na2SO3 + 3H2O Подвергается электролизу в расплаве: 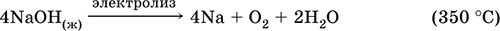 Раствор NaOH разъедает стекло (образуется NaSiO3), корродирует поверхность алюминия (образуются Na[Al(OH)4] и Н2). Получение NaOH в промышленности: а) электролиз раствора NaCl на инертном катоде: 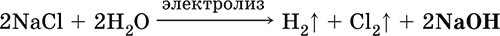 б) электролиз раствора NaCl на ртутном катоде (амальгамный способ): 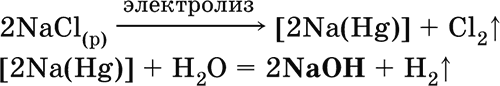 (освобождающуюся ртуть возвращают в электролизер). Едкий натр – важнейшее сырье химической промышленности. Используется для получения солей натрия, целлюлозы, мыла, красителей и искусственного волокна; как осушитель газов; реагент в извлечении из вторичного сырья и очистке олова и цинка; при переработке руд алюминия (бокситов). 5.2. Калий Калий – элемент 4-го периода и IA-группы Периодической системы, порядковый номер 19. Электронная формула атома [18Ar]4s1, степени окисления +I и 0. Имеет малую электроотрицательность (0,91), проявляет металлические (основные) свойства. Образует (как катион) многочисленные соли и бинарные соединения. Почти все соли калия хорошо растворимы в воде. В природе – девятый по химической распространенности элемент (шестой среди металлов), находится только в виде соединений. Жизненно важный элемент для всех организмов. Недостаток калия в почве восполняется внесением калийных удобрений – хлорида КCl, сульфата K2SO4 и золы растений. Калий, катион калия и его соединения окрашивают пламя газовой горелки в фиолетовый цвет (качественное обнаружение). Калий К. Серебристо-белый металл, легкий, очень мягкий, низкоплавкий. Хранят калий под слоем керосина. С ртутью образует жидкий сплав – амальгаму. По химическим свойствам похож на натрий, но еще более реакционноспособный. Во влажном воздухе тускнеет, покрываясь гидроксидной пленкой. Калий проявляет сильные восстановительные свойства. Активно сгорает на воздухе до КO2, реагирует с водородом (продукт KH), хлором (КCl), серой (K2S). Энергично и с высоким экзо-эффектом калий разлагает воду: 2К + 2H2O = 2KOH + Н2^ + 392 кДж, выделяющийся водород тут же воспламеняется. В ряду напряжений калий стоит значительно левее водорода, из разбавленных кислот HCl и H2SO4 вытесняет водород (за счет Н2O и Н+), при этом серная кислота частично восстанавливается до SO2. Получение калия в промышленности одинаково с получением натрия. Применяется калий для синтеза его соединений (КO2, KH, соли), в виде расплава (в смеси с Na) – как теплоноситель в ядерных реакторах. Гидроксид калия КОН. Основный гидроксид, щёлочь, техническое название едкое кали. Белый, имеет ионное строение К+ОН-. Плавится и кипит без разложения. Расплывается на воздухе, поглощает углекислый газ (образуется КНСO3). Вызывает тяжелые ожоги кожи и глаз. Хорошо растворим в воде (с высоким экзо-эффектом), создает в растворе сильнощелочную среду. Нейтрализуется кислотами, реагирует с кислотными оксидами, амфотерными гидроксидами и оксидами. Концентрированный раствор разъедает стекло (образуется K2SiO3). Важнейшие реакции и методы получения КОН в промышленности аналогичны свойствам и получению NaOH. Применяется КОН в производстве мыла, как адсорбент газов, дегидратирующий агент, осадитель нерастворимых гидроксидов металлов. 5.3. Кальций Кальций – элемент 4-го периода и IIA-группы Периодической системы, порядковый номер 2O. Электронная формула атома [18Ar]4s2, степени окисления +II и 0. Относится к щелочноземельным металлам. Имеет низкую электроотрицательность (1,04), проявляет металлические (основные) свойства. Образует (как катион) многочисленные соли и бинарные соединения. Многие соли кальция малорастворимы в воде. В природе – шестой по химической распространенности элемент (третий среди металлов), находится в связанном виде. Жизненно важный элемент для всех организмов. Недостаток кальция в почве восполняется внесением известковых удобрений (СаСO3, СаО, цианамид кальция CaCN2 и др.). Кальций, катион кальция и его соединения окрашивают пламя газовой горелки в темно-оранжевый цвет (качественное обнаружение). Кальций Са. Серебристо-белый металл, мягкий, пластичный. Во влажном воздухе тускнеет и покрывается пленкой из СаО и Са(ОН)2. Весьма реакционноспособный; воспламеняется при нагревании на воздухе, реагирует с водородом, хлором, серой и графитом: 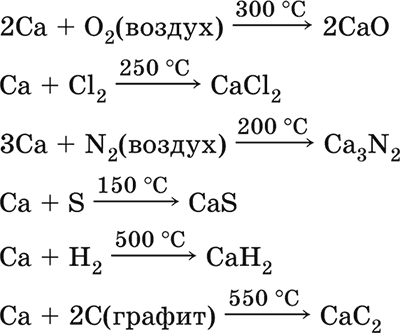 Восстанавливает другие металлы из их оксидов (промышленно важный метод — кальцийтержия): ЗСа + Cr2O3 = ЗСаО + 2Cr (700–800 °C) 5Са + V2O5 = 5СаО + 2V (950 °C) Энергично реагирует с водой (с высоким экзо-эффектом): Са + 2Н2O = Са(ОН)2 + Н2^ + 413 кДж В ряду напряжений стоит значительно левее водорода, из разбавленных кислот НCl и H2SO4 вытесняет водород (за счет Н2O и Н+): Ca + 2H+ = Са2+ + Н2^ Получение кальция в промышленности: 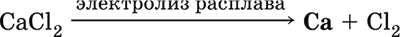 Кальций применяется для удаления примесей неметаллов из металлических сплавов, как компонент легких и антифрикционных сплавов, для выделения редких металлов из их оксидов. Оксид кальция СаО. Основный оксид. Техническое название негашёная известь. Белый, весьма гигроскопичный. Имеет ионное строение Са2+O2-. Тугоплавкий, термически устойчивый, летучий при прокаливании. Поглощает влагу и углекислый газ из воздуха. Энергично реагирует с водой (с высоким экзо-эффектом), образует сильно щелочной раствор (возможен осадок гидроксида), процесс называется гашение извести. Реагирует с кислотами, оксидами металлов и неметаллов. Применяется для синтеза других соединений кальция, в производстве Са(ОН)2, СаС2 и минеральных удобрений, как флюс в металлургии, катализатор в органическом синтезе, компонент вяжущих материалов в строительстве. Уравнения важнейших реакций: 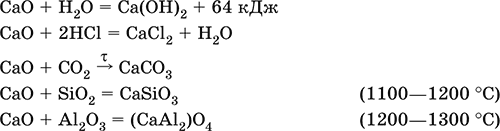 Получение СаО в промышленности – обжиг известняка (900—1200 °C): СаСO3 = СаО + СO2 Гидроксид кальция Са(ОН)2. Основный гидроксид. Техническое название гашёная известь. Белый, гигроскопичный. Имеет ионное строение Са2+(ОН-)2. Разлагается при умеренном нагревании. Поглощает влагу и углекислый газ из воздуха. Малорастворим в холодной воде (образуется щелочной раствор), еще меньше – в кипящей воде. Прозрачный раствор (известковая вода) быстро мутнеет из-за выпадения осадка гидроксида (суспензию называют известковое молоко). Качественная реакция на ион Са2+ – пропускание углекислого газа через известковую воду с появлением осадка СаСO3 и переходом его в раствор. Реагирует с кислотами и кислотными оксидами, вступает в реакции ионного обмена. Применяется в производстве стекла, белильной извести, известковых минеральных удобрений, для каустификации соды и умягчения пресной воды, а также для приготовления известковых строительных растворов – тестообразных смесей (песок + гашёная известь + вода), служащих связующим материалом для каменной и кирпичной кладки, отделки (оштукатуривания) стен и других строительных целей. Отвердевание («схватывание») таких растворов обусловлено поглощением углекислого газа из воздуха. Уравнения важнейших реакций: 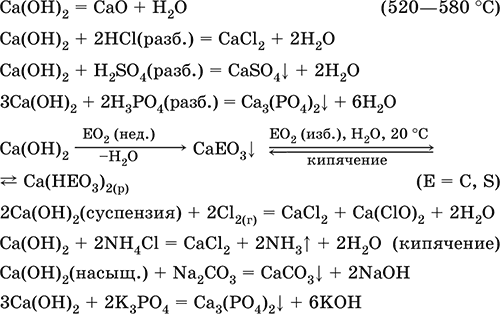 Получение Са(ОН)2 в промышленности – гашение извести СаО (см. выше). 5.4. Жёсткость воды Природная вода, проходя через известковые горные породы и почвы, обогащается солями кальция и магния (а также железа) и становится жёсткой. В жесткой воде при стирке белья увеличивается расход мыла, а ткань, впитывая соли, становится желтой и быстро ветшает. Накипь – нерастворимые соединения кальция и магния и оксид железами), осаждающиеся на внутренних стенках посуды, паровых котлов и трубопроводов. В жесткой воде дольше варятся овощи, крупы и мясо. Различают временную и постоянную жесткость воды. Временная жесткость вызвана присутствием в воде гидрокарбонатов М(НСO3)2 (М = Са, Mg) и Fe(HCO3)2. Если количественно определяют содержание ионов HCO3-, говорят о карбонатной жесткости, если содержание ионов Са2+, Mg2+ и Fe2+ – о кальциевой, магниевой или железной жесткости. Временная жесткость тем выше, чем больше содержание этих ионов в воде. Жесткость воды назвали временной потому, что она устраняется простым кипячением: Са(НСO3)2 = СаСO3v + Н2O + СO2^ Mg(HCO3)2 = Mg(OH)2v + 2СO2^ 4Fe(HCO3)2 + O2 = 2Fe2O3v + 8CO2^ + 4H2O Постоянная жесткость обусловлена другими солями кальция и магния (сульфаты, хлориды, нитраты, дигидро-ортофосфаты и др.). Такая жесткость не устраняется кипячением воды. Поэтому для удаления из жесткой воды большей части всех солей ее умягчают, используя химические реактивы и специальные (ионообменные) способы. Умягченная вода пригодна для питья и приготовления пищи. Умягчение воды достигается, если ее обработать различными осадителями – гашеной известью, содой и ортофосфатом натрия: устранение временной жесткости: Са(НСO3)2 + Са(ОН)2 = 2СаСO3v + 2Н2O Mg(HCO3)2 + Ca(OH)2 = CaMg(CO3)2v + 2Н2O 4Fe(HCO3)2 + 8Са(ОН)2 + O2 = 4FeO(OH)v + 8СаСO3v + 10Н2O устранение постоянной жесткости: Ca(NO3)2 + Na2CO3 = СаСO3v + 2NaNO3 2MgSO4 + Н2O = Na2CO3 = Mg2CO3(OH)2v + СO2^ + 2Na2SO4 3FeCl2 + 2Na3PO4 = Fe3(PO4)2v + 6NaCl В химической лаборатории и в промышленности используется полностью обессоленная вода (для питья она непригодна). Для получения обессоленной воды природную воду подвергают перегонке (дистилляции). Такая дистиллированная вода является мягкой, подобно дождевой воде. 5.5. Алюминий Алюминий – элемент 3-го периода и IIIA-группы Периодической системы, порядковый номер 13. Электронная формула атома [10Ne]3s23p1, степени окисления + III и 0. По электроотрицательности (1,47) одинаков с бериллием, проявляет амфотерные (кислотные и основные) свойства. В соединениях может находиться в составе катионов и анионов. В природе – четвертый по химической распространенности элемент (первый среди металлов), находится в химически связанном состоянии. Алюминий Al. Серебристо-белый, блестящий, легкий и пластичный металл. На воздухе покрывается матовой защитной пленкой Al2O3, весьма устойчивой и защищающей металл от коррозии; пассивируется в воде и концентрированной HNO3 (образование той же оксидной пленки). Реакционноспособный, сгорает на воздухе, при комнатной температуре реагирует с галогенами Cl2, Br2 и I2, при нагревании – с фтором, серой: 4Al(порошок) + 3O2(воздух) = 2Al2O3 (700 °C) 2Al(порошок) + ЗЕ2 = 2AlЕ3 (25 °C, Е = CI, Br) 2Al(порошок) + 3I2 = 2AlI3 (25 °C, кат. – капля Н2O) 2Al + 3F2 = 2AlF3 (600 °C) 2Al + 3S = Al2S3 (150–200 °C) Алюминий восстанавливает другие металлы из их оксидов (промышленно важный метод — алюминотермия): 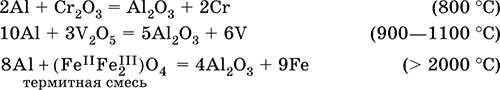 Амальгамированный алюминий, т. е. очищенный от оксидной пленки, энергично и с большим экзо-эффектом реагирует с водой: 2Al + 6Н2O = 2Al(ОН)3v + ЗН2^ + 836 кДж Алюминий – сильный (типичный) восстановитель, в ряду напряжений стоит значительно левее водорода; вытесняет водород из разбавленных кислот НCl и H2SO4: 2Al + 6Н+ = 2Al3+ + ЗН2^ и, проявляя амфотерность, из концентрированного раствора щелочей (окислитель – вода): 2Al + 2NaOH + 6Н2O = 2Na[Al(OH)4] + ЗН2^ (80 °C) Реагирует со щелочами в расплаве (также демонстрируя амфотерные свойства): 2Al + 6NaOH(T) = 2NaAlO2 + ЗН2 + 2Na2O (450 °C) Взаимодействует с разбавленной азотной кислотой: Al + 4НNO3(разб.) = Al(NO3)3 + NO^ + 2Н2O и восстанавливает Nv до N-III в реакциях с очень разбавленной азотной кислотой и ее солями: 8Al + З0НNO3(оч. разб.) = 8Al(NO3)3 + 3NH4NO3 + 9Н2O 8Al + 18Н2O + 5КОН + 3KNO3 = 8К[Al(ОН)4] + 3NH3^ (кипячение) (движущей силой этих реакций служит промежуточное выделение атомарного водорода Н0, а во второй реакции – также и образование устойчивого гидроксокомплекса [Al(OH),]-). Получение алюминия в промышленности – электролиз Al2O3 в расплаве криолита Na3[AlF6] при 950 °C: 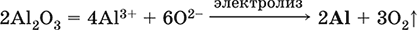 Применяется как реагент в алюминотермии для получения редких металлов и термитной сварке стальных конструкций. Алюминий – важнейший конструкционный материал, основа легких коррозионно-стойких сплавов (с магнием — дуралюмин, или дюраль, с медью — желтая алюминиевая бронза, из которой чеканят мелкую разменную монету). Чистый алюминий в больших количествах идет на изготовление посуды и электрических проводов. Оксид алюминия Al2O3. Амфотерный оксид, кислотные и основные свойства равно выражены. Белый, имеет ионное строение (Al3+)2(O2-)3. Тугоплавкий, термически устойчивый. Аморфный порошок гигроскопичен и химически активен, кристаллический – очень тверд и химически пассивен. Не реагирует с водой, разбавленными кислотами и щелочами. Переводится в раствор концентрированными кислотами и щелочами, реагирует со щелочами и карбонатом натрия при сплавлении. Применяется как сырье в производстве алюминия, для изготовления огнеупорных, химически стойких и абразивных материалов, особо чистый Al2O3 – для изготовления рубиновых лазеров и синтетических драгоценных камней (рубины, сапфиры и др.), окрашенных примесями оксидов других металлов – Cr2O3 (красный цвет), Ti2O3 и Fe2O3 (голубой цвет). Уравнения важнейших реакций: 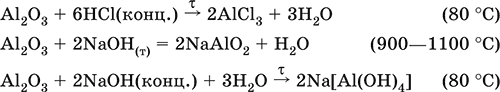 (эта реакция используется для «вскрытия» бокситов) 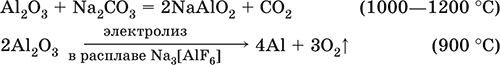 В природе входит в состав глины и бокситов, образует минерал корунд. Гидроксид алюминия Al(ОН)3. Амфотерный гидроксид, кислотные и основные свойства равно выражены. Белый, аморфный (гелеобразный) или кристаллический. Связи Al – ОН преимущественно ковалентные. Разлагается при нагревании без плавления. Практически не растворяется в воде. Реагирует с кислотами, щелочами в растворе и при сплавлении. Не реагирует с NH3 Н2O, NH4Cl, СO2, SO2 и H2S. Метагидроксид АlO(ОН) химически менее активен, чем Al(ОН)3. Промежуточный продукт в производстве алюминия. Применяется для синтеза других соединений алюминия (в том числе криолита), органических красителей, как лекарственный препарат при повышенной кислотности желудочного сока. Уравнения важнейших реакций: • термическое разложение 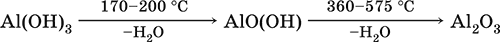 • основная и кислотная диссоциация в растворе 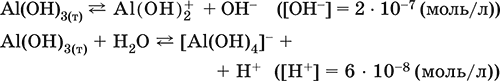 (реакции характеризуют очень малую растворимость в воде и амфотерность гидроксида, поставляющего в раствор одновременно ионы ОН и Н+ примерно в равной концентрации; гидроксид диссоциирует слабее, чем сама вода) • амфотерные свойства Al(ОН)3 + ЗНСlразб.) = AlCl3 + ЗН2O Al(ОН)3 + NaOH(т) = NaAlO2 + 2Н2O (1000 °C) Al(ОН)3 + NaOH(конц.) = Na[Al(OH)4](p) Для получения осадка Al(ОН)3 щелочь обычно не используют из-за легкости перехода осадка в раствор (см. выше), а действуют на соли алюминия гидратом аммиака. При комнатной температуре образуется Al(ОН)3, а при кипячении – менее активный АlO(ОН): 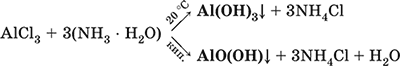 Удобный способ получения Al(ОН)3 – пропускание СO2 через раствор гидроксокомплекса: [Al(ОН)4]- + СO2 = Al(ОН)3v + HCO3- Тетрагидроксоалюминат(III) натрия Na[Al(OH)4]. Комплексная соль. С таким составом существует при комнатной температуре в концентрированном растворе NaOH. Для твердого состояния состав условный, так как при кристаллизации из раствора он усложняется (выделены Na4[Al(OH)7], Na4[Al4O3(OH)10] и др.). При прокаливании твердые соли разлагаются до диоксоалюмината(III) натрия NaAlO2, при разбавлении их растворов – до Al(ОН)3. По-разному реагируют с сильными и слабыми кислотами, с хлоридом алюминия и карбонатом аммония. Уравнения важнейших реакций: 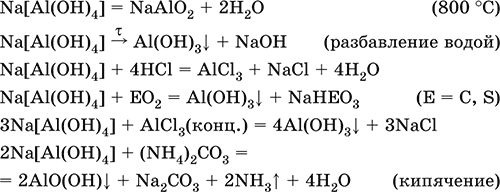 Получение: взаимодействие Al(ОН)3 и солей алюминия с NaOH в концентрированном растворе: Al(OH)3 + NaOH(конц.) = Na[Al(OH)4] AlCl3 + 4NaOH(конц.) = Na[Al(OH)4] + 3NaCl Образуется из оксида алюминия (см.) как промежуточный продукт при промышленном «вскрытии» бокситов. Примеры заданий части А1. Среди металлов главной подгруппы II группы наиболее сильным восстановителем является 1) барий 2) кальций 3) стронций 4) магний 2. При сжигании магния на воздухе образуются 1) Mg(OH)2 2) MgO 3) Mg(NO3)2 4) Mg3N2 3. Алюминий будет выделять водород из реактива 1) HNO3 (разб.) 2) NaHSO4 (разб.) 3) H2SO4 (конц.) 4) NaOH (конц.) 4. Реакция замещения протекает в растворе между алюминием и 1) Na2SO4 2) BeSO4 3) NiSO4 4) MgSO4 5. Из раствора гидрокарбоната бария выпадает осадок при добавлении реактивов 1) ВаО 2) СO2 3) Ва(ОН)2 4) H2SO4 6. Калий можно получить электролизом на угольных электродах из 1) раствора КCl 2) раствора KNO3 3) расплава КCl 4) расплава смеси КCl и MgCl2 7—8. Если внести каплю раствора 7. поваренной соли 8. хлорида калия в бесцветное пламя газовой горелки, оно станет 1) красным 2) желтым 3) зеленым 4) фиолетовым 9. Устранение временной жёсткости воды проводится по реакции 1) Са(НСO3)2 + Na3PO4 >… 2) Са(НСO3)2 + Са(ОН)2 >… 3) CaSO4 + Na2CO3 >… 4) СаCl2 + NaHCO3 >… |
|
|||
|
Главная | Контакты | Прислать материал | Добавить в избранное | Сообщить об ошибке |
||||
|
|
||||
