|
||||
|
V. ФИЗИЧЕСКАЯ ХИМИЯ 1. Основные понятия термодинамики Термодинамическая система – тело или группа тел, находящихся во взаимодействии, мысленно или реально обособленные от окружающей среды. Гомогенная система – система, внутри которой нет поверхностей, разделяющих отличающиеся по свойствам части системы (фазы). Гетерогенная система – система, внутри которой присутствуют поверхности, разделяющие отличающиеся по свойствам части системы. Фаза – совокупность гомогенных частей гетерогенной системы, одинаковых по физическим и химическим свойствам, отделенная от других частей системы видимыми поверхностями раздела. Изолированная система – система, которая не обменивается с окружающей средой ни веществом, ни энергией. Закрытая система – система, которая обменивается с окружающей средой энергией, но не обменивается веществом. Открытая система – система, которая обменивается с окружающей средой и веществом, и энергией. Параметры состояния – величины, характеризующие какое-либо макроскопическое свойство рассматриваемой системы. Термодинамический процесс – всякое изменение термодинамического состояния системы (изменения хотя бы одного параметра состояния). Обратимый процесс – процесс, допускающий возможность возвращения системы в исходное состояние без того, чтобы в окружающей среде остались какие-либо изменения. Равновесный процесс – процесс, при котором система проходит через непрерывный ряд состояний, бесконечно близких к состоянию равновесия. Характерные особенности равновесного процесса: 1) бесконечно малая разность действующих и противодействующих сил: Fex – Fin > 0; 2) совершение системой в прямом процессе максимальной работы |W| = max; 3) бесконечно медленное течение процесса, связанное с бесконечно малой разностью действующих сил и бесконечно большим числом промежуточных состояний t > ?. Самопроизвольный процесс – процесс, который может протекать без затраты работы извне, причем в результате может быть получена работа в количестве, пропорциональном произошедшему изменению состояния системы. Самопроизвольный процесс может протекать обратимо или необратимо. Несамопроизвольный процесс – процесс, для протекания которого требуется затрата работы извне в количестве, пропорциональном производимому изменению состояния системы. Энергия – мера способности системы совершать работу; общая качественная мера движения и взаимодействия материи. Энергия является неотъемлемым свойством материи. Различают потенциальную энергию, обусловленную положением тела в поле некоторых сил, и кинетическую энергию, обусловленную изменением положения тела в пространстве. Внутренняя энергия системы U – сумма кинетической и потенциальной энергии всех частиц, составляющих систему. Можно также определить внутреннюю энергию системы как ее полную энергию за вычетом кинетической и потенциальной энергии системы как целого. [U] = Дж. Теплота Q – форма передачи энергии путем неупорядоченного движения молекул, путем хаотических столкновений молекул двух соприкасающихся тел, т. е. путем теплопроводности (и одновременно путем излучения). Q > 0, если система получает теплоту из окружающей среды. [Q] = Дж. Работа W – форма передачи энергии путем упорядоченного движения частиц (макроскопических масс) под действием каких-либо сил. W > 0, если окружающая среда совершает работу над системой. [W] = Дж. Вся работа делится на механическую работу расширения (или сжатия) и прочие виды работы (полезная работа): ?W = —pdV + ?W?. Стандартное состояние твердых и жидких веществ – устойчивое состояние чистого вещества при данной температуре под давлением р = 1атм. Стандартное состоянии чистого газа – состояние газа, подчиняющееся уравнению состояния идеального газа при давлении 1 атм. Стандартные величины – величины, определенные для веществ, находящихся в стандартном состоянии (обозначаются надстрочным индексом 0). 1.1. Первое начало термодинамики Энергия неуничтожаема и несотворяема; она может только переходить из одной формы в другую в эквивалентных соотношениях. Первое начало термодинамики представляет собой постулат – оно не может быть доказано логическим путем или выведено из каких-либо более общих положений. Первое начало термодинамики устанавливает соотношение между теплотой Q, работой W и изменением внутренней энергии системы ?U. Изолированная система Внутренняя энергия изолированной системы остается постоянной. U = const или dU = 0Закрытая система Изменение внутренней энергии закрытой системы совершается за счет теплоты, сообщенной системе, и/или работы, совершенной над системой. ?U =Q +W или dU = ?Q + ?WОткрытая система Изменение внутренней энергии открытой системы совершается за счет теплоты, сообщенной системе, и/или работы, совершенной над системой, а также за счет изменения массы системы. ?U =Q +W + ?Um или dU = ?Q + ?W + i?UidniВнутренняя энергия является функцией состояния; это означает, что изменение внутренней энергии ?U не зависит от пути перехода системы из состояния 1 в состояние 2 и равно разности величин внутренней энергии U2 и U1 в этих состояниях: ?U =U2 – U1Для некоторого процесса: ?U = ?(viUi)npoд – ?(viUi)исх1.2. Применение первого начала термодинамики к гомогенным однокомпонентным закрытым системам Изохорный процесс (V = const; ?V = 0)В простейшем случае – полезная работа не совершается. dU = ?Q + ?W = ?Q – pdV dU = ?Qv = CVdT = nCVdTВсе количество теплоты, полученное системой, идет на изменение внутренней энергии.  – теплоемкость при постоянном объеме, т. е. количество теплоты, необходимое для повышения температуры системы на один градус при постоянном объеме. [СV] = Дж/град. CV – мольная теплоемкость при постоянном объеме, Дж/(моль ? град). Для идеальных газов: CV = 2/3R – одноатомный газ; CV = 5/2R – двухатомный газ. Изобарный процесс (Р = const) dU = ?Q + ?W = ?Q – pdV ?Qp = dU + pdV = d(U + pV) = dHH = U + pV – энтальпия – функция состояния системы. ?Н = ?(?iUi)прод – ?(?iUi)исх?Qp = dU + pdV =dH = CpdT – тепловой эффект изобарного процесса равен изменению энтальпии системы.  – теплоемкость при постоянном давлении. [С] = Дж/град. Cр – мольная теплоемкость при постоянном давлении, Дж/(моль ? град). Для идеальных газов: Cр = CV + R; Cр, CV = [Дж/(моль • К)]. Тепловой эффект (теплота) химической реакции – количество теплоты, выделившейся либо поглотившейся в ходе реакции при постоянной температуре. Qv = ?UV Qp = ?Up Зависимость теплового эффекта реакции от температуры. Закон КирхгоффаТемпературный коэффициент теплового эффекта химической реакции равен изменению теплоемкости системы в ходе реакции. Закон Кирхгоффа:  Для химического процесса изменение теплоемкости задается изменением состава системы: ?Ср = ?(?iCp,i)прод – ?(?iCp,i)исх или ?CV = ?(?iCV,i)прод – ?(?iCV,i)исхИнтегральная форма закона Кирхгоффа: ?НТ2 = ?НТ1 + ?Ср(Т2 – T1) или ?UT2 = ?UTi + ?СV(Т2 – T1)1.3. Второе начало термодинамики. Энтропия 1) Теплота не может самопроизвольно переходить от менее нагретого тела к более нагретому. 2) Невозможен процесс, единственным результатом которого является превращение теплоты в работу. 3) Существует некоторая функция состояния системы, названная энтропией, изменение которой следующим образом связано с поглощаемой теплотой и температурой системы: в неравновесном процессе  в равновесном процессе  S – энтропия, Дж/град,  – приведенная теплота. Статистическая интерпретация энтропииКаждому состоянию системы приписывается термодинамическая вероятность (определяемая как число микросостояний, составляющих данное макросостояние системы), тем большая, чем более неупорядоченным или неопределенным является это состояние. Энтропия – функция состояния, описывающая степень неупорядоченности системы. S = klnW – формула Больцмана. Система стремится самопроизвольно перейти в состояние с максимальной термодинамической вероятностью. Расчет абсолютной энтропии Изменение энтропии в ходе химического процесса определяется только видом и состоянием исходных веществ и продуктов реакции и не зависит от пути реакции: ?S = ?(?iSi)прод – ?(?iSi)исхВеличины абсолютной энтропии в стандартных условиях приведены в справочной литературе. 1.4. Термодинамические потенциалы Потенциал – величина, убыль которой определяет производимую системой работу. Самопроизвольно могут протекать только те процессы, которые приводят к понижению свободной энергии системы; система приходит в состояние равновесия, когда свободная энергия достигает минимального значения. F = U – TS – свободная энергия Гельмгольца – изохорно-изотермический потенциал (Дж) – определяет направление и предел самопроизвольного протекания процесса в закрытой системе, находящейся в изохорно-изотермических условиях. dF = dU – TdS или ?F = ?U – T?SG = H – TS = U + pV – TS – свободная энергия Гиббса – изобарно-изотермический потенциал (Дж) – определяет направление и предел самопроизвольного протекания процесса в закрытой системе, находящейся в изобарно-изотермических условиях. dG = dH – TdS или ?G = ?Н – T?S ?G = ?(?iGi)прод – ?(?iGi)исх ?G0 = ?(?i?Gобр0)прод – ?(?i?Gобр0)исх Условия самопроизвольного протекания процессов в закрытых системахИзобарно-изотермические (Р = const, Т = const): ?G < 0, dG < 0Изохорно-изотермические (V = const, Т = const): ?F < 0, dF < 0Термодинамическим равновесием называется такое термодинамическое состояние системы с минимальной свободной энергией, которое при постоянстве внешних условий не изменяется во времени, причем эта неизменяемость не обусловлена каким-либо внешним процессом. Условия термодинамического равновесия в закрытой системеИзобарно-изотермические (Р = const, Т = const): ?G = 0, dG = 0, d 2G > 0Изохорно-изотермические (V = const, Т = const): ?F = 0, dF = 0, d 2F > 0 Уравнения изотермы химической реакции:Для реакции v1A1 + v2A2 + … = v?1B1 + v?2B2 + …  Здесь Ci,pi – концентрации, давления реагирующих веществ в любой момент времени, отличный от состояния равновесия. Влияние внешних условий на химическое равновесиеПринцип смещения равновесия Ле Шателье-Брауна Если на систему, находящуюся в состоянии истинного равновесия, оказывается внешнее воздействие, то в системе возникает самопроизвольный процесс, компенсирующий данное воздействие. Влияние температуры на положение равновесия Экзотермические реакции: ?Н° < 0 (?U° < 0). Повышение температуры уменьшает величину константы равновесия, т. е. смещает равновесие влево. Эндотермические реакции: ?Н° > 0 (?U° > 0). Повышение температуры увеличивает величину константы равновесия (смещает равновесие вправо). 2. Фазовые равновесия Компонент – химически однородная составная часть системы, которая может быть выделена из системы и существовать вне ее. Число независимых компонентов системы равно числу компонентов минус число возможных химических реакций между ними. Число степеней свободы – число параметров состояния системы, которые могут быть одновременно произвольно изменены в некоторых пределах без изменения числа и природы фаз в системе. Правило фаз Дж. Гиббса: Число степеней свободы равновесной термодинамической системы С равно числу независимых компонентов системы К минус число фаз Ф плюс число внешних факторов, влияющих на равновесие: С = К – Ф + n. Для системы, на которую из внешних факторов влияют только температура и давление, можно записать: С = К – Ф + 2. Принцип непрерывности – при непрерывном изменении параметров состояния все свойства отдельных фаз изменяются также непрерывно; свойства системы в целом изменяются непрерывно до тех пор, пока не изменится число или природа фаз в системе, что приводит к скачкообразному изменению свойств системы. Согласно принципу соответствия, на диаграмме состояния системы каждой фазе соответствует часть плоскости – поле фазы. Линии пересечения плоскостей отвечают равновесию между двумя фазами. Всякая точка на диаграмме состояния (т. н. фигуративная точка) отвечает некоторому состоянию системы с определенными значениями параметров состояния. 2.1. Диаграмма состояния воды К = 1. В системе возможны три фазовых равновесия: между жидкостью и газом (линия ОА), твердым телом и газом (линия ОВ), твердым телом и жидкостью (линия OC). Три кривые имеют точку пересечения О, называемую тройной точкой воды, – отвечают равновесию между тремя фазами и С = 0; три фазы могут находиться в равновесии лишь при строго определенных значениях температуры и давления (для воды тройная точка отвечает состоянию с Р = 6,1 кПа и Т = 273,16 К).  Внутри каждой из областей диаграммы (АОВ, ВOC, АOC) система однофазна; С = 2 (система бивариантна). На каждой из линий число фаз в системе равно двум, и, согласно правилу фаз, система моновариантна: С = 1 – 2 + 2 = 1, т. е. для каждого значения температуры имеется только одно значение давления. Влияние давления на температуру фазового перехода описывает уравнение Кла-узиуса – Клапейрона:  V 2, V1 – изменение молярного объема вещества при фазовом переходе. Кривая равновесия «твердое вещество – жидкость» на диаграмме состояния воды наклонена влево, а на диаграммах состояния остальных веществ – вправо, т. к. плотность воды больше, чем плотность льда, т. е. плавление сопровождается уменьшением объема (AV < 0). В этом случае увеличение давления будет понижать температуру фазового перехода «твердое тело – жидкость» (вода – аномальное вещество). Для всех остальных веществ (т. н. нормальные вещества) ?Vпл > 0 и, согласно уравнению Клаузиуса-Клапейрона, увеличение давления приводит к повышению температуры плавления. 3. Свойства растворов 3.1. Термодинамика растворов Раствор – гомогенная система, состоящая из двух или более компонентов, состав которой может непрерывно изменяться в некоторых пределах без скачкообразного изменения ее свойств. Диффузия в растворах Диффузия – самопроизвольный процесс выравнивания концентрации вещества в растворе за счет теплового движения его молекул или атомов. Закон Фика: количество вещества, диффундирующее за единицу времени через единицу площади поверхности пропорционально градиенту его концентрации:  где j – диффузионный поток; D – коэффициент диффузии. Уравнение Эйнштейна-Смолуховского:  где ? – вязкость среды; R – радиус диффундирующих частиц. Растворимость газов в газахЗакон Дальтона: общее давление газовой смеси равно сумме парциальных давлений всех входящих в нее газов: Робщ = ?pi и pi = xiРобщЗакон Генри-Дальтона: растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью: Ci = kpi, где Ci – концентрация раствора газа в жидкости; k – коэффициент пропорциональности, зависящий от природы газа. Как правило, при растворении газа в жидкости выделяется теплота (к < 0), поэтому с повышением температуры растворимость уменьшается. Формула Сеченова: X =Х0е-kСэлгде X и Х0 – растворимость газа в чистом растворителе и растворе электролита с концентрацией С. 3.2. Коллигативные свойства растворов неэлектролитов Коллигативными (коллективными) называются свойства растворов относительно свойств растворителя, зависящие главным образом от числа растворенных частиц. Давление насыщенного пара разбавленных растворовПар, находящийся в равновесии с жидкостью, называется насыщенным. Давление такого пара р0 называется давлением или упругостью насыщенного пара чистого растворителя. Первый закон Рауля. Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причем коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом: pi = pi0 xiДля бинарного раствора, состоящего из компонентов А и В: относительное понижение давления пара растворителя над раствором равно мольной доле растворенного вещества и не зависит от природы растворенного вещества:  Растворы, для которых выполняется закон Рауля, называют идеальными растворами. Давление пара идеальных и реальных растворов Если компоненты бинарного (состоящего из двух компонентов) раствора летучи, то пар над раствором будет содержать оба компонента. Общее Состав, мол. доли в (хв) давление пара: p = pA0xA + pB0xB = pA0(1 – xB) + pB0xB = pA0 – xB(pA0 – pB0) Если молекулы данного компонента взаимодействуют друг с другом сильнее, чем с молекулами другого компонента, то истинные парциальные давления паров над смесью будут больше, чем вычисленные по первому закону Рауля (положительные отклонения, ?Н тв > 0). Если же однородные частицы взаимодействуют друг с другом слабее, чем разнородные, парциальные давления паров компонентов будут меньше вычисленных (отрицательные отклонения, ?Hраств < 0). Температура кристаллизации разбавленных растворовВторой закон Рауля. Понижение температуры замерзания раствора ?Тзам прямо пропорционально моляльной концентрации раствора: ?Tзам = Т0 – Т = КСm, где Т0 – температура замерзания чистого растворителя; Т – температура замерзания раствора; К – криоскопическая постоянная растворителя, град/кг моль,  Т02 – температура замерзания растворителя; М – молекулярная масса растворителя, ?Нпл – мольная теплота плавления растворителя. Температура кипения разбавленных растворовТемпература кипения – температура, при которой давление насыщенного пара становится равным внешнему давлению. Повышение температуры кипения растворов нелетучих веществ ?ТК = Тк – Тк0 пропорционально понижению давления насыщенного пара и прямо пропорционально моляльной концентрации раствора: ?Ткип = ЕСm, где Е – эбулиоскопическая постоянная растворителя, град/кг • моль,  Осмотическое давление разбавленных растворов Осмотическое давление разбавленных растворов Осмос – преимущественно одностороннее прохождение молекул растворителя через полупроницаемую мембрану в раствор или молекул растворителя из раствора с меньшей концентрацией в раствор с большей концентрацией. Давление, которое необходимо приложить к раствору, чтобы предотвратить перемещение растворителя в раствор через мембрану, разделяющую раствор и чистый растворитель, численно равно осмотическому давлению ? (Па). Принцип Вант-Гоффа: осмотическое давление идеального раствора равно тому давлению, которое оказывало бы растворенное вещество, если бы оно, находясь в газообразном состоянии при той же температуре, занимало бы тот же объем, который занимает раствор: ? = CRT. Изотонические растворы – два раствора с одинаковым осмотическим давлением (?1 = ?2). Гипертонический раствор – раствор, осмотическое давление которого больше, чем у другого (?1 > ?2). Гипотонический раствор – раствор, осмотическое давление которого меньше, чем у другого (?1 < ?2). 3.3. Растворы электролитов Степень диссоциации ? – отношение числа молекул n, распавшихся на ионы, к общему числу молекул N: 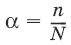 Изотонический коэффициент i Ван-Гоффа – отношение фактического числа частиц в растворе электролита к числу частиц этого раствора без учета диссоциации. Если из N молекул продиссоциировало n, причем каждая молекула распалась на ? ионов, то 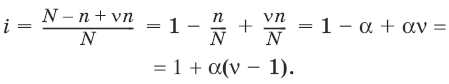 Для неэлектролитов i = 1. Для электролитов 1 < i ? ?. 3.4. Коллигативные свойства растворов электролитов: 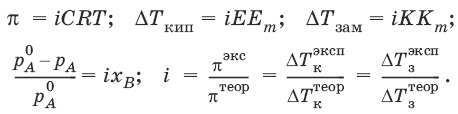 Теория электролитической диссоциации Аррениуса Теория электролитической диссоциации Аррениуса 1. Электролиты в растворах распадаются на ионы – диссоциируют. 2. Диссоциация является обратимым равновесным процессом. 3. Силы взаимодействия ионов с молекулами растворителя и друг с другом малы (т. е. растворы являются идеальными). Диссоциация электролитов в растворе происходит под действием полярных молекул растворителя; наличие ионов в растворе предопределяет его электропроводность. По величине степени диссоциации электролиты подразделяются на три группы: сильные (? ? 0,7), средней силы (0,3 < ? < 0,7) и слабые (? ? 0,3). Слабые электролиты. Константа диссоциацииДля некоторого электролита, распадающегося в растворе на ионы в соответствии с уравнением: АаВb - аАx- + bВy+ Для бинарного электролита:  Для разбавленных растворов можно считать, что (1 – ?) = 1 и К ? ?2С.  – закон разбавления Оствальда: степень диссоциации слабого электролита возрастает с разбавлением раствора. Активность растворенного вещества – эмпирическая величина, заменяющая концентрацию, – активность (эффективная концентрация) а, связанная с концентрацией через коэффициент активности f, который является мерой отклонения свойств реального раствора от идеального: а = fC; а+ = f+С+; а_ = f_C_.Для бинарного электролита:  – средняя активность электролита;  – средний коэффициент активности. Предельный закон Дебая-Хюккеля для бинарного электролита: lg f = -0,51z 2I ?, где z – заряд иона, для которого рассчитывается коэффициент активности; I – ионная сила раствора I = 0,5?(Сiri2). 4. Электропроводность растворов электролитов Проводники I рода – металлы и их расплавы, в которых электричество переносится электронами. Проводники II рода – растворы и расплавы электролитов с ионным типом проводимости. Электрический ток есть упорядоченное перемещение заряженных частиц. Всякий проводник, по которому течет ток, представляет для него определенное сопротивление R, которое, согласно закону Ома, прямо пропорционально длине проводника l и обратно пропорционально площади сечения S; коэффициентом пропорциональности является удельное сопротивление материала ? – сопротивление проводника, имеющего длину 1 см и сечение 1 см2:  Величина W, обратная сопротивлению, называется электропроводностью – количественной меры способности раствора электролита проводить электрический ток.  Удельная электропроводность ?(к) – электропроводность проводника I рода длиной 1 м с площадью поперечного сечения 1 м2 или электропроводность 1 м3 (1 см3) раствора электролита (проводника II рода) при расстоянии между электродами 1 м (1 см) и площади электродов 1 м2 (1 см2).  Молярная электропроводность раствора) ? – электропроводность раствора, содержащего 1 моль растворенного вещества и помещенного между электродами, расположенными на расстоянии 1 см друг от друга.  Молярная электропроводность как сильных, так и слабых электролитов увеличивается с уменьшением концентрации (т. е. с увеличением разведения раствора V = 1/C), достигая некоторого предельного значения ?0(??), называемого молярной электропроводностью при бесконечном разведении. Для бинарного электролита с однозарядными ионами при постоянной температуре и напряженности поля 1 В • м-1: ? = ?F(u + + и?),где F – число Фарадея; и+, и? – абсолютные подвижности (м2В-1с-1) катиона и аниона – скорости движения данных ионов в стандартных условиях, при разности потенциалов в 1В на 1 м длины раствора. ?+ = Fu+; ?? = Fu?,где ?+, ?? – подвижности катиона и аниона, Ом • м2 • моль-1 (Ом • см2 • моль-1). ? = ?(?+ + ??)Для сильных электролитов ? ?1 и ? = ?+ + ?? При бесконечном разбавлении раствора (V > ?, ?+ > ??+, ?? > ???, ? > 1) как для сильного, так и для слабого электролитов ?? = ??+ – ??? – закон Кольрауша: молярная электропроводность при бесконечном разведении равна сумме электролитических подвижностей ??+, ??? катиона и аниона данного электролита. Ионы Н+ и OH? обладают аномально высокой подвижностью, что связано с особым механизмом переноса заряда этими ионами – эстафетным механизмом. Между ионами гидроксония Н3O+ и молекулами воды, а также между молекулами воды и ионами OH? непрерывно происходит обмен протонами по уравнениям: Н3O+ + Н2O > Н2O + Н3O+ Н2O + OH? > OH? + Н2O 5. Электрохимические процессы 5.1. Электродные потенциалы. Гальванические элементы. ЭДС При соприкосновении двух химически или физически разнородных материалов (металл 1 (проводник I рода) – металл 2 (проводник I рода), металл (проводник I рода) – раствор соли металла (проводник II рода), раствор электролита 1 (проводник II рода) – раствор электролита 2 (проводник II рода) и т. д.) между ними возникает двойной электрический слой (ДЭС). ДЭС является результатом упорядоченного распределения противоположно заряженных частиц на границе раздела фаз. Образование ДЭС приводит к скачку потенциала ?, который в условиях равновесия металл (проводник I рода) – раствор соли металла (проводник II рода) называется галъвани-потенциалом. Система: металл (Me) – водный раствор соли данного Me – называется электродом или полуэлементом и схематически изображается следующим образом: Меn+ | Me Электрод (п/э) записывается так, чтобы все вещества, находящиеся в растворе, были помещены слева, а электродный материал – справа от вертикальной черты. ? > 0, если на электроде протекает реакция восстановления Меn+ + nе? - Ме0, ? < 0, если на электроде протекает реакция окисления Ме0 - Меn+ + nе?. Электродным потенциалом ЕМеn+/Ме называется равновесная разность потенциалов, возникающая на границе фаз проводник I рода/проводник II рода и измеренная относительно стандартного водородного электрода.  уравнение Нернста, где n – число электронов, участвующих в электродной реакции; СМеn+ – концентрация катионов; ЕМеn+/Ме – стандартный электродный потенциал. Контактный потенциал ?? – равновесный скачек потенциалов, возникающий на границе раздела двух проводников I рода. Диффузионный потенциал ?диф – равновесная разность потенциалов, возникающая на границе фаз проводник II рода/проводник II рода. Гальванический элемент (г. э.) – электрическая цепь, состоящая из двух или нескольких п.э. и производящая электрическую энергию за счет протекающей в ней химической реакции, причем стадии окисления и восстановления химической реакции пространственно разделены. Электрод, на котором при работе гальванического элемента протекает процесс окисления, называется анодом, электрод, на котором идет процесс восстановления, – катодом. Правила ИЮПАК для записи гальванических элементов и реакций, протекающих в них1. В г. э. работа производится, поэтому ЭДС элемента считается величиной положительной. 2. Величина ЭДС гальванической цепи Е определяется алгебраической суммой скачков потенциала на границах раздела всех фаз, но так как на аноде протекает окисление, то ЭДС рассчитывают, вычитая из числового значения потенциала катода (правого электрода) значение потенциала анода (левого электрода) – правило правого полюса. Поэтому схему элемента записывают так, чтобы левый электрод был отрицательным (протекает окисление), а правый – положительным (протекает процесс восстановления). 3. Границу раздела между проводником I рода и проводником II рода обозначают одной чертой. 4. Границу между двумя проводниками II рода изображают пунктирной чертой. 5. Электролитный мостик на границе двух проводников II рода обозначают двумя пунктирными чертами. 6. Компоненты одной фазы записывают через запятую. 7. Уравнение электродной реакции записывают так, чтобы слева располагались вещества в окисленной форме (Ох), а справа – в восстановленной (Red). Гальванический элемент Даниэля-Якоби состоит из цинковой и медной пластин, погруженных в соответствующие растворы ZnSO4 и CuSO4, которые разделены солевым мостиком с раствором KCl: электролитический мостик обеспечивает электрическую проводимость между растворами, но препятствует их взаимной диффузии. (-) Zn | Zn 2+:: Cu 2+| Cu (+)Реакции на электродах: Zn0 > Zn2+ + 2e? Cu2+ + 2е? > Cu0Суммарный окислительно-восстановительный процесс: Cu2+ + Zn0 > Cu0 + Zn2+Работа тока гальванического элемента (и, следовательно, разность потенциалов), будет максимальна при его обратимой работе, когда процессы на электродах протекают бесконечно медленно и сила тока в цепи бесконечно мала. Максимальная разность потенциалов, возникающая при обратимой работе гальванического элемента, есть электродвижущая сила (ЭДС) гальванического элемента Е. ЭДС элемента EZn/Cu = ?Cu2+/Cu + ?Zn2+/Zn + ?к + ?диф. Без учета ?диф и ?к: EZn/Cu = ?Cu2+/Cu + ?Zn2+/Zn = ЕCu2+/Cu + Е Zn2+/Zn – гальванические элементы, состоящие из двух одинаковых металлических электродов, опущенных в растворы соли этого металла с различными концентрациями С1 > С2. Катодом в этом случае будет являться электрод с большей концентрацией, т. к. стандартные электродные потенциалы обоих электродов равны.  Концентрационные цепи  Единственным результатом работы концентрационного элемента является перенос ионов металла из более концентрированного раствора в менее концентрированный. Работа электрического тока в концентрационном гальваническом элементе – это работа диффузионного процесса, который проводится обратимо в результате пространственного разделения его на два противоположных по направлению обратимых электродных процесса. 5.2. Классификация электродов Электроды первого рода. Металлическая пластинка, погруженная в раствор соли того же металла. При обратимой работе элемента, в который включен электрод, на металлической пластинке идет процесс перехода катионов из металла в раствор либо из раствора в металл.  Электроды второго рода. Металл покрыт малорастворимой солью этого металла и находится в растворе, содержащем другую растворимую соль с тем же анионом. Электроды этого типа обратимы относительно аниона.  Электроды сравнения – электроды с точно известными и воспроизводимыми значениями потенциалов. Водородный электрод представляет собой платиновую пластинку, омываемую газообразным водородом, погруженную в раствор, содержащий ионы водорода. Адсорбируемый платиной водород находится в равновесии с газообразным водородом. Pt, Н2 / Н+Электрохимическое равновесие на электроде: 2Н+ + 2е? - Н2.Потенциал стандартного водородного электрода (с активностью ионов Н+ 1 моль/л и давлением водорода 101,3 кПа) принят равным нулю. Электродный потенциал нестандартного водородного электрода:  Каломельный электрод состоит из ртутного электрода, помещенного в раствор KCl, определенной концентрации и насыщенный каломелью Hg2Cl2: Hg / Hg2Cl2, KClКаломельный электрод обратим относительно анионов хлора  Хлорсеребряный электрод – обратим относительно анионов хлора: Ag / AgCl, KCl Если раствор KCl – насыщенный, то EAgCl = 0,2224 – 0,00065(t – 25), В. Индикаторные электроды. Электроды, обратимые относительно иона водорода, используются на практике для определения активности этих ионов в растворе. Хингидронный электрод представляет собой платиновую проволоку, опущенную в сосуд с исследуемым раствором, в который предварительно помещают избыточное количество хингидрона С6Н4O2 • С6Н4(OH)2 – соединения хинона С6Н4O2 и гидрохинона С6Н4(OH)2, способных к взаимопревращению в равновесном окислительно-восстановительном процессе, в котором участвуют ионы водорода: С6Н4O2 + 2H+ + 2е? > С6Н4(OH)2 Наиболее часто употребляется стеклянный электрод в виде трубки, оканчивающейся тонкостенным стеклянным шариком. Шарик заполняется буферным раствором с определенным значением рН, в который погружен вспомогательный электрод (обычно хлорсеребряный). Для измерения рН стеклянный электрод погружают в исследуемый раствор в паре с электродом сравнения. Шарик стеклянного электрода предварительно обрабатывают в течение длительного времени раствором кислоты. При этом ионы водорода внедряются в стенки шарика, замещая катионы щелочного металла. Электродный процесс сводится к обмену ионами водорода между двумя фазами – исследуемым раствором и стеклом: Нр-р - Нст+.  Стандартный потенциал Ест0 для каждого электрода имеет свою величину, которая со временем изменяется; поэтому стеклянный электрод перед каждым измерением рН калибруется по стандартным буферным растворам с точно известным рН. Окислительно-восстановите льные электродыЭлектрод, состоящий из инертного проводника 1-го рода, помещенного в раствор электролита, содержащего один элемент в различных степенях окисления, называется окислительно-восстановительным или редокс-электродом. Электродная реакция: Охn+ + nе? - Red. В данном случае инертный Me принимает косвенное участие в электродной реакции, являясь посредником передачи электронов от восстановленной формы Me (Red) к окисленной (Ох) или наоборот.  6. Поверхностные явления и адсорбция 6.1. Поверхностное натяжение и адсорбция по Гиббсу Поверхностными явлениями называют процессы, происходящие на границе раздела фаз и обусловленные особенностями состава и строения поверхностного (пограничного) слоя. Gs = ?s,где Gs – поверхностная энергия Гиббса системы, Дж; ? – коэффициент пропорциональности, называемый поверхностным натяжением, Дж/м2; s – межфазная поверхность, м2.  Поверхностное натяжение о есть величина, измеряемая энергией Гиббса, приходящейся на единицу площади поверхностного слоя. Оно численно равно работе, которую необходимо совершить против сил межмолекулярного взаимодействия для образования единицы поверхности раздела фаз при постоянной температуре.  Из модели Дюпре, поверхностное натяжение равно силе, стремящейся уменьшить поверхность раздела и отнесенной к единице длины контура, ограничивающего поверхность  Способность растворенных веществ изменять поверхностное натяжение растворителя называется поверхностной активностью g:  Классификация веществ по влиянию на поверхностное натяжение растворителя Классификация веществ по влиянию на поверхностное натяжение растворителя 1. Поверхностно-активные вещества (ПАВ) – понижают поверхностное натяжение растворителя (?р-р < ?0) g > 0 (по отношению к воде – органические соединения дифильного строения). 2. Поверхностно-инактивные вещества (ПИВ) – незначительно повышают поверхностное натяжение растворителя (?р-р > ?0) g < 0 (неорганические кислоты, основания, соли, глицерин, ?-аминокислоты и др). 3. Поверхностно-неактивные вещества (ПНВ) – практически не изменяют поверхностного натяжения растворителя (?р-р = ?0) g = 0 (по отношению к воде веществами являются сахароза и ряд других). Правило Дюкло-Траубе: в любом гомологическом ряду при малых концентрациях удлинение углеродной цепи на одну группу CH2 увеличивает поверхностную активность в 3–3,5 раза: 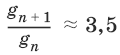 Для водных растворов жирных кислот (уравнение Шишковского): 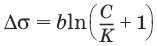 где b и К – эмпирические постоянные, b одинаково для всего гомологического ряда, К увеличивается для каждого последующего члена ряда в 3–3,5 раза. Процесс самопроизвольного изменения концентрации какого-либо вещества у поверхности раздела двух фаз называется адсорбцией. Адсорбентом называется вещество, на поверхности которого происходит изменение концентрации другого вещества – адсорбата. Изотерма адсорбции Гиббса: 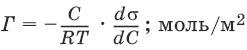 Избыток адсорбата в поверхностном слое по сравнению с его первоначальным количествам в этом слое характеризует избыточную, или так называемую гиббсов-скую, адсорбцию (Г). 6.2. Адсорбция на границе твердое тело – газ Физическая адсорбция возникает за счет ван-дер-ваальсовых взаимодействий адсорбированной молекулы с поверхностью, характеризуется обратимостью и уменьшением адсорбции при повышении температуры, т. е. экзотермичностью (тепловой эффект физической адсорбции обычно близок к теплоте сжижения адсорбата 10–80 кДж/моль). Химическая адсорбция (хемосорбция) осуществляется путем химического взаимодействия молекул адсорбента и адсорбата, обычно необратима; является локализованной, т. е. молекулы адсорбата не могут перемещаться по поверхности адсорбента. Так как хемосорбция является химическим процессом, требующим энергии активации порядка 40-120 кДж/моль, повышение температуры способствует ее протеканию. Уравнение Генри (мономолекулярная адсорбция на однородной поверхности при низких давлениях или малых концентрациях): Г = Кс или Г = Кр,К – константа адсорбционного равновесия, зависящая от природы адсорбента и адсорбата; С, р – концентрация растворенного вещества или давление газа. Теория мономолекулярной адсорбции Лэнгмюра 1. Адсорбция является локализованной и вызывается силами, близкими к химическим. 2. Адсорбция происходит на однородной поверхности адсорбента. 3. На поверхности может образоваться только один слой адсорбированных молекул. 4. Процесс адсорбции является обратимым и равновесным. Изотерма адсорбции Лэнгмюра: 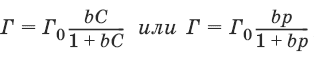 где Г0 – емкость монослоя – константа, равная предельной адсорбции, наблюдаемой при относительно больших равновесных концентрациях, моль/м2; b – константа, равная отношению константы скорости адсорбции и константе скорости десорбции. Уравнение Фрейндлиха (адсорбция на неоднородной поверхности): Г = КФсn, где. КФ – константа, численно равная адсорбции при равновесной концентрации, равной единице; n – константа, определяющая кривизну изотермы адсорбции (n = 0,1–0,6). Молекулярная адсорбция из растворов:  где С0 – исходная концентрация адсорба-та; С – равновесная концентрация адсорбата; V – объем раствора адсорбата; m – масса адсорбента. Площадь S0, приходящаяся на одну молекулу в насыщенном адсорбционном слое, – посадочная площадка:  м2/молекула. Толщина адсорбционного слоя:  где М – молекулярная масса ПАВ; ? – плотность ПАВ. Правило Ребиндера: на полярных адсорбентах лучше адсорбируются полярные ад-сорбаты из малополярных растворителей; на полярных адсорбентах – неполярные адсорбаты из полярных растворителей. Ориентация молекул ПАВ на поверхности адсорбента схематически изображена на рисунке:  6.3. Адсорбция из растворов электролитов Обменная адсорбция – процесс обмена ионов между раствором и твердой фазой, при котором твердая фаза поглощает из раствора ионы какого-либо знака (катионы либо анионы) и вместо них может выделять в раствор эквивалентное число других ионов того же знака. Ввсегда специфична, т. е. для данного адсорбента к обмену способны только определенные ионы; обменная адсорбция обычно необратима. Правило Пакета-Пескова-Фаянса: на поверхности кристаллического твердого тела из раствора электролита специфически адсорбируется ион, который способен достраивать его кристаллическую решетку или может образовывать с одним из ионов, входящих в состав кристалла, малорастворимое соединение. 7. Коллоидные (дисперсные) системы Коллоидной (дисперсной) системой называется гетерогенная система, в которой одна из фаз представлена мелкими частицами, равномерно распределенными в объеме другой однородной фазы. Это ультрамикрогетерогенные системы, состоящие из частиц дисперсной фазы – совокупности раздробленных частиц, размер которых лежит в пределах 10-9-10-5 м, и непрерывной дисперсионной среды, в которой распределены эти частицы. Признаки коллоидного состояния вещества – дисперсность и гетерогенность. Степень дисперсности ? – величина, обратная среднему диаметру или, для несферических частиц, обратная среднему эквивалентному диаметру d (м-1):  Удельная поверхность – отношение общей площади поверхности дисперсной фазы SДФ к ее общему объему или к ее массе:  7.1. Классификация и способы получения дисперсных систем Классификация по агрегатному состоянию фаз   Дисперсной системы, у которой и дисперсная фаза, и дисперсионная среда являются газами, не существует, так как газы неограниченно растворимы друг в друге. Классификация систем по размеру частиц дисперсной фазы: 1) высокодисперсные, 10-9_10-7 м (рубиновое стекло); 2) среднедисперсные, 10-7_10-5 м (растворимый кофе); 3) грубодисперсные, > 10-5 м (капли дождя). Способы получения коллоидных систем ДиспергированиеФизическое диспергирование: механическое измельчение с использованием коллоидных мельниц; электрическое распыление веществ; диспергирование ультразвуком и другие методы. Чтобы не дать образовавшимся частицам слипаться, диспергирование производят в присутствии стабилизатора – электролита или вещества, адсорбирующегося на границе раздела фаз (поверхностно-активные вещества). Химическое диспергирование (пептизация): перевод в коллоидное состояние свежеприготовленного осадка с помощью пептизатора. КонденсацияФизическая конденсация: 1) метод замены растворителя, который заключается в том, что в истинный раствор вещества добавляется смешивающаяся с растворителем жидкость, в которой само вещество малорастворимо; вследствие понижения растворимости вещества в новом растворителе раствор становится пересыщенным, и часть вещества конденсируется, образуя частицы дисперсной фазы; 2) метод конденсации из паров; исходное вещество находится в паре; при понижении температуры пар становится пересыщенным и частично конденсируется, образуя дисперсную фазу. Химическая конденсация: любая химическая реакция, в результате которой образуется плохо растворимое соединение; чтобы при этом получить коллоидный раствор, реакцию необходимо вести в разбавленном растворе при небольшой скорости роста частиц, одно из исходных веществ берется в избытке и является стабилизатором. 7.2. Оптические свойства дисперсных систем При падении света на дисперсную систему могут наблюдаться следующие явления: прохождение света частицами дисперсной фазы (наблюдается для прозрачных систем, в которых частицы много меньше длины волны падающего света (r << ?); преломление света частицами дисперсной фазы (если эти частицы прозрачны); отражение света частицами дисперсной фазы (если частицы непрозрачны); преломление и отражение света наблюдается для систем, в которых частицы много больше длины волны падающего света (r >> ?). Визуально это явление выражается в мутности этих систем; рассеяние света наблюдается для систем, в которых частицы дисперсной фазы меньше, но соизмеримы с длиной волны падающего света (r ? 0,1 ?); адсорбция (поглощение) света дисперсной фазой с превращением световой энергии в тепловую. Уравнение Рэлея:  где I, I0 – интенсивность рассеянного и падающего света; V – объем одной частицы; ? – частичная концентрация (число частиц в единице объема); ? – длина волны; n1, n0 – показатели преломления частиц и среды соответственно. Явление различной окраски коллоидного раствора в проходящем и рассеянном (отраженном) свете называется опалесценцией. В случае окрашенных растворов происходит наложение собственной окраски и окраски, вызванной опалесценцией (явление дихроизма света). 7.3. Молекулярно-кинетические свойства Для коллоидных систем характерно броуновское движение – непрерывное беспорядочное движение частиц микроскопических и коллоидных размеров. Это движение тем интенсивнее, чем выше температура и чем меньше масса частицы и вязкость дисперсионной среды. Диффузия – самопроизвольно протекающий процесс выравнивания концентрации частиц. Закон Фика:  Вследствие большого размера коллоидных частиц диффузия в коллоидных системах замедленна по сравнению с истинными растворами. Осмотическое давление:  где mобщ – масса растворенного вещества; m – масса одной частицы; V – объем системы; NA – число Авогадро; Т – абсолютная температура; ? – частичная концентрация; k – постоянная Больцмана. Для сферических частиц:  где ?m – масса дисперсной фазы в единице объема раствора; ? – плотность дисперсионной среды; r – радиус частиц. 7.4. Строение мицеллы Мицеллой лиофобной системы называется гетерогенная микросистема, которая состоит из микрокристалла дисперсной фазы, окруженного сольватированными ионами стабилизатора. Потенциалопределяющими называются ионы, адсорбирующиеся на поверхности частички твердой фазы (агрегата) и придающие ей заряд. Агрегат вместе с потенциалопределяющими ионами составляет ядро мицеллы. Противоионы – ионы, группирующиеся вблизи ядра мицеллы. Расположение противоионов в дисперсионной среде определяется двумя противоположными факторами: тепловым движением (диффузией) и электростатическим притяжением.  Противоионы, входящие в состав плотного адсорбционного слоя, называются «связанными» и вместе с ядром составляют коллоидную частицу, или гранулу. Коллоидная частица (гранула) имеет заряд, знак которого обусловлен знаком заряда потенциалопределяющих ионов. Противоионы, образущие диффузный слой, – «подвижные», или «свободные». Коллоидная частица с окружающим ее диффузным слоем сольватированных про-тивоионов составляют мицеллу. В отличие от коллоидной частицы мицелла электронейтральна и не имеет строго определенных размеров.  В мицелле с ионным стабилизатором на границе раздела фаз имеется ДЭС, возникает разность потенциалов между дисперсной фазой и дисперсионной средой – термодинамический потенциал ф (межфазный), который определяется свойствами данной дисперсной системы, а также зарядом и концентрацией потенциалопределяющих ионов, адсорбированных на твердой фазе.  Перемещение заряженных коллоидных частиц в неподвижной жидкости к одному из электродов под действием внешнего электрического поля называется электрофорезом. Поверхность, по которой происходит перемещение, называется поверхностью скольжения. Величина скачка потенциала на границе фаз, находящихся в движении относительно друг друга при электрофорезе и в броуновском движении, т. е. на поверхности скольжения, называется электрокинетическим или ?-потенциалом (дзета-потенциал). 7.5. Устойчивость и коагуляция Устойчивость дисперсных систем характеризует способность дисперсной фазы сохранять состояние равномерного распределения частиц во всем объеме дисперсионной среды. Существует два вида относительной устойчивости дисперсных систем: седимента-ционная и агрегативная. Седиментационная устойчивость – способность системы противостоять действию силы тяжести. Седиментация – это оседание частиц в растворе под действием силы тяжести. Условие седиментационного равновесия: частица движется с постоянной скорость, т. е. равномерно, сила трения уравновешивает силу тяжести: 6??rU = 4/3?r3(? – ?0)g,где ? – плотность дисперсной фазы, ?0 – плотность дисперсионной среды, g – ускорение силы тяжести, ? – вязкость среды.  Агрегативная устойчивость характеризует способность частиц дисперсной фазы противодействовать их слипанию между собой и тем самым сохранять свои размеры. При нарушении агрегативной устойчивости происходит коагуляция – процесс слипания частиц с образованием крупных агрегатов. В результате коагуляции система теряет свою седиментационную устойчивость, т. к. частицы становятся слишком крупными и не могут участвовать в броуновском движении. Причины коагуляции: > изменение температуры; > действие электрического и электромагнитного полей; > действие видимого света; > облучение элементарными частицами; > механическое воздействие; > добавление электролита и др. Наибольший практический интерес вызывает коагуляция электролитами. Виды коагуляции электролитамиКонцентрационная коагуляция наступает под действием индифферентных электролитов. Индифферентным называется электролит, при введении которого межфазный потенциал <р не изменяется. Данный электролит не содержит таких ионов, которые были бы способны к специфической адсорбции на частицах по правилу Па-нета-Фаянса, т. е. не способны достраивать кристаллическую решетку агрегата: 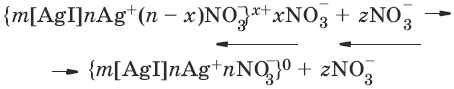 Состояние, при котором диффузный слой исчезнет и коллоидная частица становится электронейтральной, называется изоэлектрическим – электрокинетический потенциал (?) равен нулю, наступает коагуляция. Формула мицеллы в таком состоянии приобретает вид: {m[AgI]nAg+nNO3?}0. Нейтрализационная коагуляция происходит при добавлению к золю неиндифферентного электролита. Неиндифферентным называется электролит, способный изменить межфазный (?) и линейно с ним связанный электрокинетический (?) потенциалы, т. е. данный электролит содержит ионы, способные специфически адсорбироваться на поверхности агрегата, достраивать его кристаллическую решетку или химически взаимодействовать с потенциалоп-ределяющими ионами.  Обратимый процесс, при котором коагулят вновь переходит в коллоидное состояние, называется пептизацией или дезагрегацией. Правила коагуляции1. Все сильные электролиты, добавленные к золю в достаточном количестве, вызывают его коагуляцию. Минимальная концентрация электролита, вызывающая коагуляцию золя за определенный короткий промежуток времени, называется порогом коагуляции:  где Сэл – концентрация электролита-коагулятора; Vэл – объем добавленного электролита; Vзоля(обычно 10 мл) – объем золя. 2. Коагулирующим действием обладает тот ион, заряд которого совпадает по знаку с зарядом противоионов мицеллы лиофобного золя (заряд коагулирующего иона противоположен заряду коллоидной частицы). Этот ион называют ионом-коагулянтом. 3. Коагулирующая способность иона – коагулянта тем больше, чем больше заряд иона:  Правило значности: ?1 : ?2 : ?3 = 1/16 : 1/26 : 1/36 = 729 : 11 : 1Коагулирующая способность иона при одинаковом заряде тем больше, чем больше его кристаллический радиус. Ag+ > Cs+ > Rb+ > NH4+ > K+ > Na+ > Li+ – лиотропный ряд. Коллоидной защитой называется повышение агрегативной устойчивости золя путем введения в него ВМС (высокомолекулярное соединение) или ПАВ (поверхностно-активного вещества). Защитным числом называется минимальное количество миллиграммов сухого вещества, которое необходимо для защиты 10 мл золя при добавлении к нему электролита в количестве, равном порогу коагуляции. |
|
|||
|
Главная | Контакты | Прислать материал | Добавить в избранное | Сообщить об ошибке |
||||
|
|
||||
